Линейчатый спектр атома водорода
ЭЛЕМЕНТЫ КВАНТОВОЙ ФИЗИКИ АТОМОВ, МОЛЕКУЛ И ТВЕРДЫХ ТЕЛ
1 Модели атомов
А) Модель атома Томсона (1905 г.).
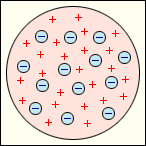 Атом представляет собой непрерывно заряженный положительным зарядом шар радиуса порядка 10-10м, внутри которого около своих положений равновесия колеблются электроны. Суммарный отрицательный заряд электронов равен положительному заряду шара, поэтому атом в целом нейтрален.
Атом представляет собой непрерывно заряженный положительным зарядом шар радиуса порядка 10-10м, внутри которого около своих положений равновесия колеблются электроны. Суммарный отрицательный заряд электронов равен положительному заряду шара, поэтому атом в целом нейтрален.
Рис.6.1.1
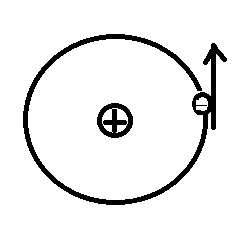 Б) Модель атома Резерфорда (ядерная (планетарная) 1909 г)
Б) Модель атома Резерфорда (ядерная (планетарная) 1909 г)
Вокруг положительного ядра, имеющего заряд Ze, размер
10-15 - 10-14 м и массу, практически равную массе атома, в области с линейными размерами порядка 10-10 м по круговым орбитам под действием сил электростатического притяжения движутся электроны.
Заряд ядра равен суммарному заряду электронов, так как атомы нейтральны.
Рис.6.1.2
( Z – порядковый номер в Периодической системе элементов Менделеева, е- элементарный заряд).
Недостатки модели атома Резерфорда
1) Эта модель не согласуется с наблюдаемой стабильностью атомов; противоречит законам классической физики: вращающийся вокруг ядра электрон должен непрерывно излучать электромагнитные волны, терять свою энергию. В результате электроны будут приближаться к ядру и в конце концов упадут на него.
2) Эта модель не объясняет наблюдаемые на опыте оптические спектры атомов (они не непрерывны, как следует из теории Резерфорда, а состоят из узких спектральных линий, т.е. атомы излучают и поглощают электромагнитные волны лишь определенных частот, характерных для данного химического элемента).
Линейчатый спектр атома водорода
Совокупность монохроматических составляющих световых колебаний, соответствующих процессам излучения и поглощения в атомах, называется спектром.
Спектр излучения является важной характеристикой вещества, позволяющей установить его состав, строение и свойства атомов и молекул.
Спектры излучения атомов состоят из отдельных спектральных линий или групп близко расположенных линий; их называют линейчатыми спектрами. Каждому элементу присущ свой, характерный только для него, спектр излучения, позволяющий определить элемент, которому он принадлежит. Вид линейчатого спектра не зависит от способа возбуждения атома.
Принято различать три вида спектров: сплошные, полосатые и линейчатые. Сплошной спектр получается при разложении света, излучаемого раскаленными твердыми телами, расплавами и жидкостями. Сплошной спектр имеет вид цветной полосы с непрерывным переходом одного спектрального цвета в другой. Полосатые спектры испускаются возбужденными молекулами газа. В таких спектрах большое число отдельных линий образует характерные группы, в каждой из которых линии у одного края располагаются очень тесно. Спектр имеет вид отдельных полос, четких с одного края, и размытых с другого. Светящиеся атомарные газы и пары излучают свет, при разложении которого получается спектр, состоящий из отдельных линий. Такие спектры называются линейчатыми.
Наиболее простой линейчатый спектр имеет атомарный водород, (Атом состоит из протона и распределенного вокруг него электрона). Если электрон поглощает порцию энергии, то атом переходит в возбужденное состояние. Если же электрон отдает энергию, то атом переходит из более высокого в менее высокое энергетическое состояние. Обычно переходы из более высокого энергетического состояния в менее высокое сопровождаются квантовым излучением энергии в форме света. Однако, возможны также и безизлучательные переходы. В этом случае атом переходит в менее высокое энергетическое состояние без излучения света, а избыток энергии отдает, например, другому атому при их столкновении.
По мере увеличения числа электронов в атомах, спектры атомов усложняются. При экспериментальном изучении линейчатых спектров оказалось, что расположение линий в спектрах подчиняется определенным закономерностям. В каждой серии расстояние между линиями закономерно убывает при переходе от длинных волн к более коротким. Закономерность расположения линий в спектре водорода математически можно описать с помощью формул, которые называются сериальными.
Дата добавления: 2017-11-21; просмотров: 3192;











