Спектр атома водорода по Бору
Энергия испущенного фотона при переходе атома водорода из состояния n в состояние m с меньшей энергией
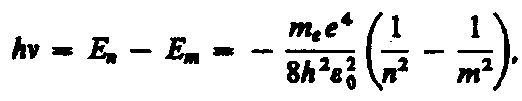
Частота излучения:
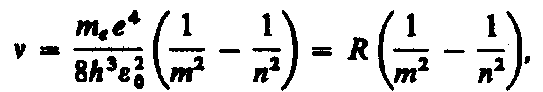
( 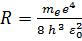 - постоянная Ридберга, совпадающая со значениями в эмпирических формулах для спектра излучения атома водорода).
- постоянная Ридберга, совпадающая со значениями в эмпирических формулах для спектра излучения атома водорода).
Подставляя в формулу для частоты m=1 и n= 2,3,4,.., получаем группу линий, образующих серию Лаймана и соответствующих переходам с возбужденных уровней n=2,3,4…, на основной (m=1). При подстановке m=2 и n=3,4,5,6 и соответствующих им значений n получаем серии Бальмера, Пашена, Брэкета, Пфунда и Хэмфри.
Спектральные серии водорода:
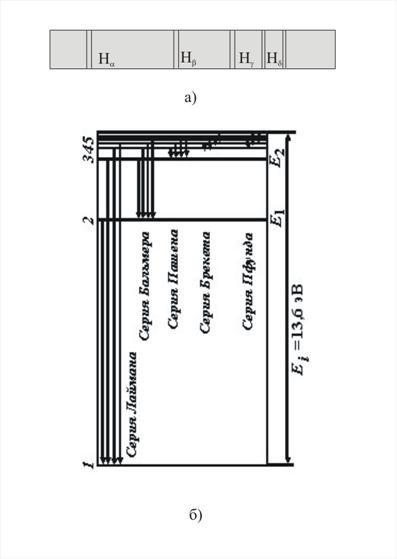
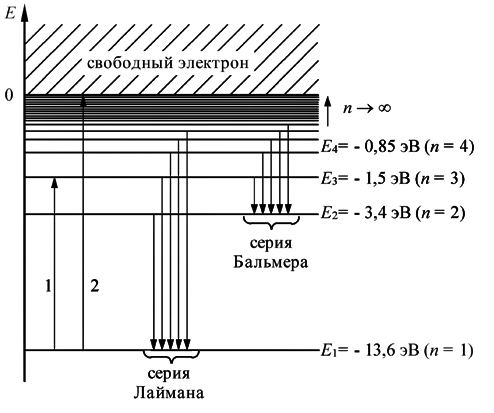
Рис.6.3.2 Рис.6.3.3
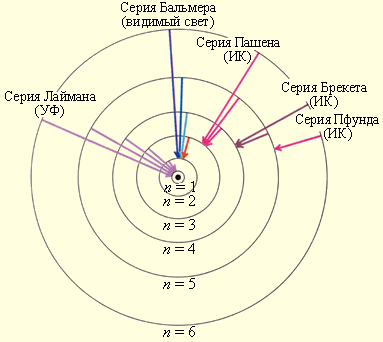 Рис.6.3.4
Рис.6.3.4
Схема энергетических уровней атома приведена на Рис.6.3.3, где спектральные серии излучения атома водорода поставлены в соответствие энергетическим уровням.
Целое число, определяющее энергетический уровень атома, называется главным
квантовым числом. Если n = 1, то атом находится в основном состоянии, ему соответствует радиус орбиты электрона r = а, если n > 1 – в возбужденном.
Энергия основного уровня атома водорода E1 =-13,55 эВ, а максимальная энергия возбужденного состояния = 0 .
Энергия связи - энергия, необходимая для удаления электрона из атома, находящегося в данном возбужденном состоянии. Например, энергия связи первого возбужденного состояния (n=2) равна 3,38эВ.
Энергия возбуждения- Энергия, которую надо сообщить атому, чтобы электрон из основного состояния перешел в возбужденное. Например, энергия для первого возбужденного состояния (n=2) Eвозб=3,38эВ-(-13,6 эВ)=10,2 эВ
Процесс отрыва электрона от атома называется ионизацией, а энергия необходимая для этого - энергией ионизации. Это энергия, необходимая для удаления электрона из атома, находящегося в основном состоянии. Для атома водорода E1=13,6 эВ
Несвязанные электроны, имеющие энергию E > 0 , соответствуют состояниям непрерывного энергетического спектра. Квантовые переходы между дискретным и сплошным энергетическим спектрами проявляются в виде сплошного спектра излучения.
Внешнее излучение поглощают, прежде всего, атомы, находящиеся на основном энергетическом уровне. При этом они переходят в возбужденное состояние. Поэтому в спектре поглощения атома водорода присутствует, прежде всего, спектральные линии Лаймана.
При поглощении атомом кванта энергии (фотона) атом переходит в возбужденное состояние, при этом электрон переходит на более отдаленную орбиту и его связь с ядром слабеет.
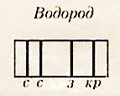
Переходы в первое возбужденное состояние (Е2) с верхних уровней соответствует частотам видимой части (кр з с с) спектра водорода.
Линейчатый спектр атома водорода состоит из линий, сгруппированных в серии:
 n = I - серия Лаймана - ультрафиолетовое излучение,
n = I - серия Лаймана - ультрафиолетовое излучение,
n = 2 - серия Бальмера - видимое излучение,
n = 3 - серия Пашена - инфракрасное излучение и т.д.
Рис.6.3.5
Дата добавления: 2017-11-21; просмотров: 3214;











