Стереохимия аминокислот
Получаемые из белков аминокислоты, за исключением глицина, оптически активны, так как они содержат асимметрический атом углерода. Это α-углерод в цепи аминокислоты. Поэтому, аминокислоты существуют в двух пространственных конфигурациях (D и L), являющихся зеркальными изомерами (рис. 5-1).
|
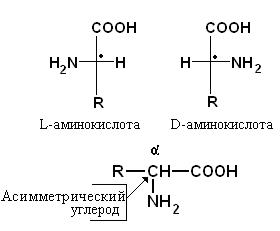
2 изомера аминокислоты аланин:
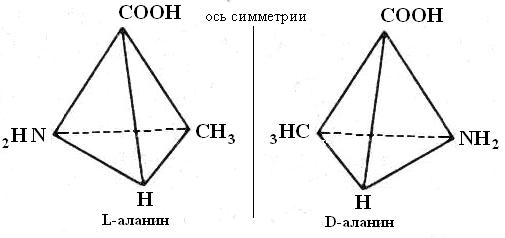
Рис. 5-1. Стереоизомерия аминокислот на примере аланина
Ι. Аминокислоты с гидрофобным радикалом
(содержат группы –СН2–, –СН3, ароматические кольца)
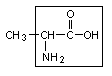
1. Аланин – ала
|
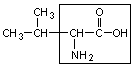
2. Валин – вал
|
3. Лейцин – лей
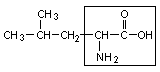
|
4. Изолейцин – иле
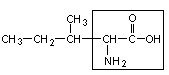
|
5. Метионин – мет
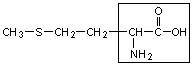
|
6. Фенилаланин – фен
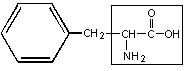
|
7. Триптофан – три
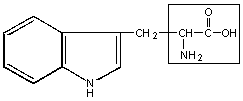
|
8. Пролин – про
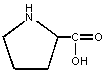
|
ΙΙ. Аминокислоты с гидрофильным не заряженным радикалом
(содержат группы –ОН, –SН, амидную)
1. Глицин – гли
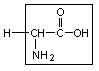
|
2. Серин – сер
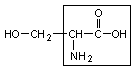
|
3. Треонин – тре
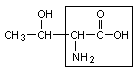
|
4. Цистеин – цис
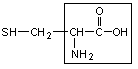
|
5. Тирозин – тир
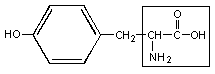
|
6. Аспарагин – асн
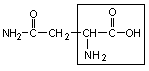
|
7. Глутамин – глн
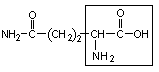
|
ΙΙΙ. Аминокислоты с гидрофильным, заряженным отрицательно, радикалом
1. Аспарагиновая кислота – асп
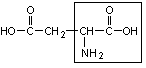
|
2. Глутаминовая кислота – глу
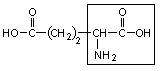
|
Рис. 5-2. Классификация аминокислот
ΙV. Аминокислоты с гидрофильным, заряженным положительно, радикалом
1. Лизин – лиз
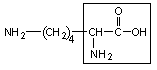
|
2. Аргинин – арг
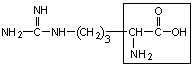
|
3 Гистидин – гис
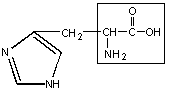
|
Дата добавления: 2021-10-28; просмотров: 559;











