Зависимость свойств элементов от строения их атомов
Атомный радиус
Абсолютный радиус атома нельзя измерить, так как электроны обладают двойственной природой. Поэтому за радиус свободного атома принимают положение главного максимума плотности внешних электронных оболочек. Это так называемый орбитальный радиус(рис.2.2а,б).
Если рассматривать только относительные величины атомных радиусов, то легко обнаружить периодичность их зависимости от номера элемента.
В периодах орбитальные атомные радиусы по мере увеличения заряда ядра 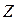 в общем монотонно уменьшаются из-за роста степени взаимодействия внешних электронов с ядром, так как происходит одновременное увеличение положительного заряда ядра и отрицательного заряда, создаваемого электронами.
в общем монотонно уменьшаются из-за роста степени взаимодействия внешних электронов с ядром, так как происходит одновременное увеличение положительного заряда ядра и отрицательного заряда, создаваемого электронами.
В подгруппах радиусы в основном увеличиваются из-за возрастания числа электронных оболочек. В связи с этим возрастают и металлические свойства элементов.
У 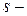 и
и 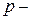 элементов изменение радиусов как в периодах, так и в подгруппах более выражено, чем у
элементов изменение радиусов как в периодах, так и в подгруппах более выражено, чем у 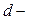 и
и 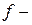 элементов, поскольку
элементов, поскольку 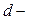 и
и 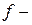 электроны являются внутренними. Уменьшение радиусов
электроны являются внутренними. Уменьшение радиусов 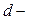 и
и 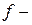 элементов в периодах называется
элементов в периодах называется 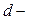 и
и 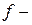 сжатием. Следствием
сжатием. Следствием 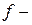 сжатия является то, что атомные радиусы электронных аналогов
сжатия является то, что атомные радиусы электронных аналогов 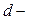 элементов пятого и шестого периодов практически одинаковы:
элементов пятого и шестого периодов практически одинаковы:
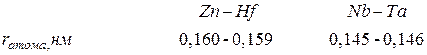
При изучении строения молекул было установлено, что радиусы атомов существенно зависят от типа химической связи и степени окисления элемента. Например:
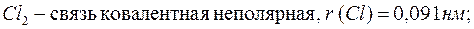
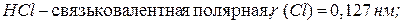
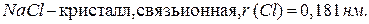
Следовательно, чем больше перекрытие электронных облаков атомов при образовании молекул, тем меньше радиус атома. Аналогичная ситуация наблюдается при изменении степени окисления элементов – радиусы уменьшаются при увеличении степени окисления:
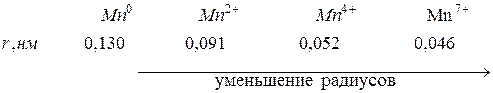
Это так называемые эффективные радиусы ионов.
Большое значение в химии и физике имеют и ковалентные радиусы, величина которых равняется половине межатомного расстояния в молекулах или кристаллах простых веществ.
Образование ионов приводит к изменению атомных радиусов. При этом радиусы катионов всегда меньше, а радиусы анионов всегда больше радиусов соответствующих атомов.
Радиусы некоторых атомов и ионов представлены на рисунке  и в таблицах
и в таблицах  и
и 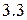 .
.
Таблица 3.2– Орбитальные, ковалентные и ионные радиусы 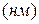 атомов некоторых элементов
атомов некоторых элементов 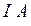 и
и 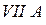 главных подгрупп
главных подгрупп
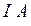
| 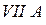
| ||||||||
| Элемент | Орбиталь- ный радиус | Ковалент-ный радиус | Заряд иона | Ионный радиус | Элемент | Орбиталь- ный радиус | Ковaлен-тный радиус | Заряд иона | Ионный радиус |
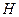
| 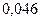
| 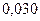
| 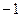
| 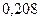
| |||||
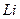
| 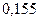
| 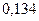
| 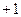
| 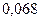
| 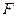
| 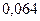
| 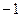
| 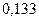
| |
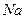
| 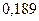
| 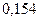
| 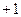
| 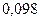
| 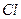
| 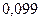
| 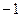
| 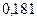
| |
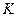
| 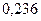
| 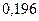
| 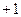
| 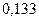
| 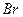
| 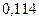
| 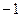
| 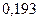
| |
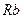
| 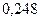
| 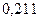
| 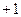
| 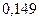
| 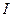
| 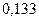
| 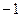
| 0,220 | |
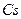
| 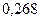
| 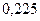
| 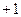
| 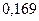
|
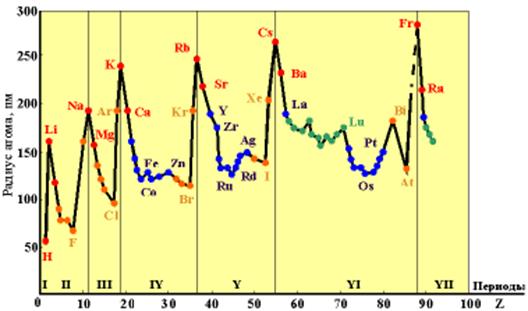
Рисунок 3.2 Зависимость орбитальных радиусов от атомного номера элемента.
Таблица 3.3 – Ковалентные и ионные радиусы 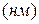 атомов некоторых элементов
атомов некоторых элементов 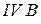 и
и 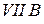 побочных подгрупп
побочных подгрупп
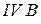
| 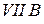
| ||||||
| Ионный радиус | Ковалентный радиус | Заряд иона | Ионный радиус | Элемент | Ковалентный радиус | Заряд иона | Ионный радиус |
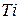
| 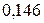
| 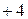
| 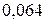
| 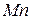
| 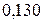
| 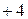
| 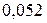
|
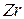
| 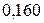
| 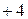
| 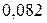
| 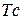
| 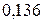
| 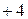
| - |
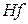
| 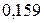
| 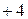
| 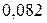
| 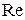
| 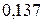
| 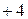
| 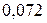
|
Из рисунка 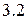 и таблицы
и таблицы 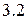 видно, что у элементов главных подгрупп радиусы атомов действительно существенно изменяются как при переходе вдоль периода слева направо (они уменьшаются), так и в группах сверху вниз (они увеличиваются).
видно, что у элементов главных подгрупп радиусы атомов действительно существенно изменяются как при переходе вдоль периода слева направо (они уменьшаются), так и в группах сверху вниз (они увеличиваются).
В побочных подгруппах изменения радиусов сверху вниз происходит не столь заметно (таблица 3.3), что объясняется, с одной стороны, эффектом экранирования, когда валентные электроны заполняют 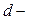 и
и 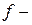 подуровни внутренних энергетических уровней, а с другой стороны, эффектом
подуровни внутренних энергетических уровней, а с другой стороны, эффектом 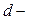 и
и 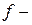 сжатия – постепенным уменьшением вдоль периода атомных и ионных радиусов.
сжатия – постепенным уменьшением вдоль периода атомных и ионных радиусов.
Энергия ионизации
Энергией ионизации атома I называется количество энергии, необходимое для отрыва электрона от невозбуждённого атома или иона.
Энергия ионизации 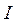 выражается в
выражается в 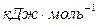 :
: 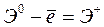 ,
, 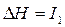 – первый потенциал ионизации;
– первый потенциал ионизации; 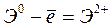 ,
, 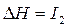 – второй потенциал ионизации и т.д. Причём
– второй потенциал ионизации и т.д. Причём 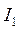 <
< 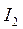 <
< 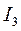 <
< 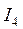 … (Э – элемент).
… (Э – элемент).
Энергия ионизации характеризует металлические (восстановительные) свойства элементов. Чем меньше энергия ионизации, тем в большей мере элемент проявляет металлические свойства.
Таблица 3.4 – Энергия ионизации атомов некоторых металлов
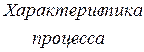
| 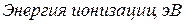
| |||
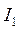
| 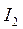
| 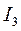
|  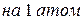
| |
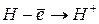
| 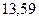
| - | - | 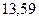
|
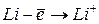
| 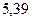
| - | - | 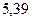
|
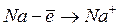
| 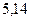
| - | - | 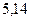
|
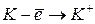
| 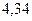
| - | - | 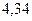
|
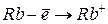
| 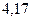
| - | - | 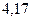
|
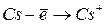
| 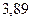
| - | - | 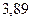
|
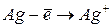
| 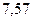
| - | - | 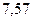
|
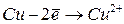
| 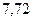
| 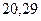
| - | 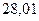
|
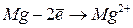
| 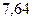
| 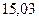
| - | 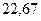
|
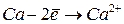
| 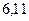
| 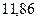
| - | 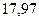
|
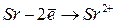
| 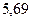
| 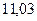
| - | 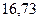
|
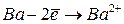
| 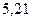
| 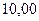
| - | 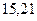
|
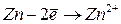
| 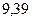
| 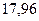
| - | 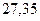
|
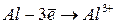
| 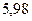
| 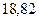
| 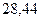
| 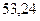
|
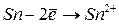
| 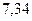
| 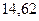
| - | 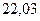
|
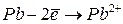
| 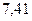
| 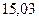
| - | 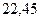
|
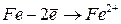
| 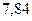
| 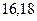
| - | 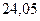
|
Энергия ионизации изменяется периодически по мере заполнения электронами оболочек атомов (рисунок 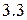 ), а её численные значения для некоторых из них приведены в таблице
), а её численные значения для некоторых из них приведены в таблице 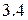
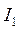 максимальна у элементов с полностью заполненными валентными оболочками (у благородных газов), при переходе к следующему периоду
максимальна у элементов с полностью заполненными валентными оболочками (у благородных газов), при переходе к следующему периоду 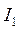 резко понижается – она минимальна у щелочных металлов.
резко понижается – она минимальна у щелочных металлов.
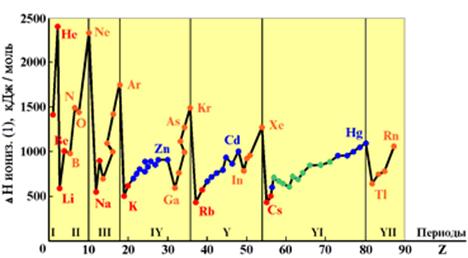
Рисунок 3.3 Потенциалы ионизации нейтральных атомов
Энергия связи электрона с ядром пропорциональна 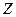 и обратно пропорциональна среднему (орбитальному) радиусу оболочки. Атомные радиусы
и обратно пропорциональна среднему (орбитальному) радиусу оболочки. Атомные радиусы 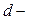 и
и 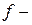 элементов с ростом
элементов с ростом 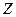 в периоде уменьшаются незначительно по сравнению с
в периоде уменьшаются незначительно по сравнению с 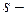 и
и 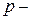 элементами, поэтому их потенциалы растут также незначительно.
элементами, поэтому их потенциалы растут также незначительно.
В главных подгруппах потенциалы ионизации с ростом 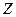 уменьшаются вследствие увеличения числа электронных оболочек и экранирования заряда ядра электронами внутренних оболочек.
уменьшаются вследствие увеличения числа электронных оболочек и экранирования заряда ядра электронами внутренних оболочек.
В побочных подгруппах 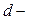 электроны экранируются не только электронами заполненных оболочек, но и внешними
электроны экранируются не только электронами заполненных оболочек, но и внешними 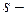 электронами. Поэтому потенциал ионизации
электронами. Поэтому потенциал ионизации 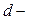 элементов с ростом
элементов с ростом 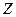 в подгруппе увеличивается, хотя и незначительно.
в подгруппе увеличивается, хотя и незначительно.
Чем меньше потенциал ионизации, тем легче атом отдаёт электрон. Поэтому восстановительная способность нейтральных атомов с ростом 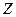 в периоде уменьшается, в главных подгруппах растёт, а в побочных падает.
в периоде уменьшается, в главных подгруппах растёт, а в побочных падает.
Дата добавления: 2016-06-05; просмотров: 3180;











