Энергия сродства к электрону и электроотрицательность
Другой важной в химии характеристикой атома является энергия сродства к электрону – энергия, выделяющаяся при присоединении электрона к нейтральному атому: 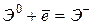 . Она характеризует способность атомов проявлять неметаллические свойства. Чем больше электронное сродство, тем более сильным окислителем является данный элемент. Экспериментальное определение энергии сродства к электрону
. Она характеризует способность атомов проявлять неметаллические свойства. Чем больше электронное сродство, тем более сильным окислителем является данный элемент. Экспериментальное определение энергии сродства к электрону 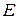 значительно сложнее, чем определение энергии ионизации. Величины
значительно сложнее, чем определение энергии ионизации. Величины 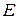
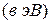 для некоторых атомов приведены ниже в таблице
для некоторых атомов приведены ниже в таблице 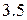 :
:
Таблица 3.5 – Значения энергии сродства к электрону 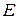 для некоторых атомов
для некоторых атомов
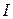 период период
| 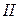 период период
| |
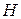 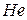
| 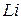 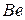 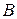 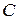 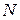 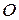 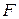
| |
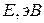
| 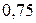 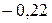
| 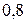 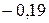 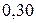 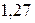 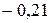 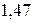 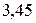
|
Немонотонность изменения сродства к электрону в периоде также обусловлена сравнительной устойчивостью полностью и наполовину заполненных оболочек. Самый сильный из всех элементарных окислителей – фтор (он обладает и самым малым атомным радиусом из всех элементов 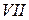 группы).
группы).
Отметим, что в отличие от ионизации присоединение двух и более электронов энергетически затруднено, и многозарядные одноатомные отрицательные ионы в свободном состоянии не существуют. Окислительной способностью не обладают нейтральные атомы с устойчивыми конфигурациями 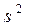 и
и 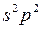 и переходные элементы. У остальных элементов в таблице Менделеева окислительная способность нейтральных атомов повышается слева направо и снизу вверх.
и переходные элементы. У остальных элементов в таблице Менделеева окислительная способность нейтральных атомов повышается слева направо и снизу вверх.
Универсальной характеристикой металлических и неметаллических свойств элементов является их электроотрицательность 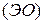 , которая выражается полусуммой энергии ионизации
, которая выражается полусуммой энергии ионизации 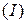 и энергии сродства к электрону
и энергии сродства к электрону 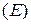 :
:
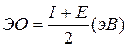
Дата добавления: 2016-06-05; просмотров: 2515;











