Лекция № 29. Элементы IB- и IIB-подгрупп (подгруппы меди и цинка)
29.1 Элементы IB-подгруппы (подгруппы меди)
Медь, серебро и золото - полные электронные аналоги с общей электронной формулой
(n-1)d10ns1 при ожидаемой (n-1)d9ns2. Изменение электронной формулы вызвано провалом электрона и образованием завершенного d-подуровня. Вследствие устойчивости конфигурации d10 для элементов подгруппы меди типичной является степень окисления +1. Кроме этого, возможно проявление более высоких степеней окисления: +2 для меди и +3, +5 для золота.
Медь - довольно распространенный элемент земной коры (0,0036 мол.%), содержание серебра и золота незначительно (1,6×10-6 и 5×10-8 мол.%). Основные минералы меди: медный колчедан (халькопирит) - CuFeS2, медный блеск - Cu2S, куприт - Cu2O. Серебро и золото образуют сульфидные минералы, а также встречаются в самородном состоянии.
Медь является биометаллом, входит в состав гемоцианина - переносчика кислорода в крови моллюсков. Известно около 30 белков и ферментов, в состав которых также входит катион меди.
Медь имеет красную окраску, серебро - белый металл, золото - металл желтого цвета. Медь, серебро и особенно золото отличаются высокой пластичностью, тепло- и электропроводностью.
| Свойства | Cu | Ag | Au |
| Плотность, г/см3 | 9,94 | 10,5 | 19,3 |
| Т.пл., °С |
Медь широко применяется в электротехнике для изготовления проводов, печатных плат и контактов, в металлургии для получения разнообразных сплавов (латунь, бронза, монетные сплавы), в химической промышленности в качестве катализатора. Значительная часть серебра и золота в виде сплавов идет на изготовление монет и ювелирных изделий. Кроме этого, серебро и золото широко применяются в радиотехнике и электронике для изготовления контактов. Серебро применяется при изготовлении химической аппаратуры для работы в агрессивных средах. Коллоидное серебро используется в некоторых медицинских препаратах. Золото - основной валютный металл.
Медь - довольно инертный металл, хотя при нагревании реагирует с кислородом, серой и галогенами:
t t t
2Cu + O2 = 2CuO; Cu + Cl2 = CuCl2 2Cu + S = Cu2S
При высокой температуре медь реагирует также с фосфором, мышьяком, кремнием, углеродом с образованием соединений нестехиометрического и переменного состава (бертолидов).
В ряду стандартных электродных потенциалов медь стоит после водорода, поэтому с кислотами, не являющимися окислителями, не реагирует. Металлическая медь растворяется в азотной и концентрированной серной кислоте. Легко растворяется медь также в растворах цианидов, в аммиаке и растворах солей железа(III):
4Cu + 8NaCN + 2H2O + O2 = 4Na[Cu(CN)2] + 4NaOH
4Cu + 8NH3 + 2H2O + O2 = 4[Cu(NH3)2](OH)
Cu + 2FeCl3 = CuCl2 + 2FeCl2
Серебро и золото - химически весьма инертны. Серебро при нагревании реагирует с галогенами, серой, фосфором и углеродом с образованием AgHal, Ag2S, Ag3P, Ag4C. Во влажном воздухе уже при комнатной температуре серебро реагирует с сероводородом:
4Ag + 2H2S + O2 = 2Ag2S + 2H2O
Золото легко реагирует с галогенами (с хлором в присутствии влаги уже на холоду):
2Au + 3Cl2 = 2AuCl3
С кислородом, серой, азотом и бором золото не реагирует, при нагревании вступает во взаимодействие с теллуром и фосфором, образуя AuTe2, Au3P4.
Серебро растворимо в азотной и концентрированной серной кислотах. Золото - в царской водке (смесь концентрированных азотной и соляной кислот в соотношении 1:3):
Au + HNO3 + 4HCl = H[AuCl4] + NO + 2H2O
Серебро и золото легко растворяются в растворах цианидов щелочных металлов в присутствии окислителей:
2Au + O2 + 4KCN = 2K[Au(CN)2] + 2KOH
Соединения в степени окисления +1 наиболее характерны для серебра. У меди и особенно у золота данная степень окисления проявляется реже. Бинарные соединения меди(I) и серебра(I) (оксиды, сульфиды, галогениды) - кристаллические вещества, малорастворимые в воде. Из солей серебра(I) хорошо растворимы в воде нитрат и перхлорат. Оксиды меди(I) и серебра(I) амфотерны, гидроксиды - нестабильны. Медь(I) и серебо(I) образуют устойчивые комплексные ионы как катионного, так и анионного типа, в которых обычно проявляют координационное число 2:
AgCl + 2NH3 = [Ag(NH3)2]Cl; Agl + KI = K[AgI2]
Соединения меди, и особенно золота, в степени окисления +1 - сильные восстановители и легко окисляются уже кислородом воздуха:
4CuCl + O2 + 4HCl = 4CuCl2 + 2H2O
Степень окисления +2 характерна только для меди, которая образует бинарные соединения (оксид, галогениды и пр.), гидроксид, разнообразные соли и координационные соединения. Оксид и гидроксид меди(II) амфотерны и растворяются как в кислотах, так и в щелочах:
CuO + 2HCl = CuCl2 + H2O
CuO + 2KOH + 2H2O = K2[Cu(OH)4]
Гидроксид меди(II) термически неустойчив:
t
Cu(OH)2 = CuO + H2O
Из солей меди(II) хорошо растворимы в воде хлорид, нитрат, сульфат. Иодид и цианид меди(II) нестабильны, поскольку анионы окисляются катионом меди:
Cu2+ + 3I- = CuI¯ + I2
Наиболее широко из солей меди применяется медный купорос - CuSO4×5H2O. В основном он используется для производства минеральных красок и для борьбы с вредителями и заболеваниями растений.
Степень окисления +3 наиболее характерна для золота. Золото(III) образует галогениды, амфотерный гидроксид и разнообразные координационные соединения анионного типа.
Au(OH)3 + NaOH = Na[Au(OH)4]
Au(OH)3 + HCl = H[AuCl4] + 3H2O
29.2 Элементы IIB-подгруппы (подгруппы цинка)
Цинк, кадмий и ртуть имеют общую электронную формулу (n-1)d10ns2 и завершают ряды d-элементов. Устойчивость завершенной d-оболочки обуславливает проявление этими элементами степени окисления +2. Ртуть может проявлять также степень окисления +1 за счет образования катиона [Hg-Hg]2+. Завершенность предвнешнего уровня роднит элементы подгруппы цинка с непереходными металлами. В тоже время цинк, кадмий и ртуть подобно переходным металлам склонны к образованию координационных соединений.
Цинк - распространенный элемент (0,0015 мол. %). Основные минералы цинка: цинковая обманка или сфалерит - ZnS, смитсонит - ZnCO3. Кадмий и ртуть - элементы редкие, но образуют рудные месторождения: гринокит - CdS, киноварь - HgS. Ртуть встречается в самородном состоянии.
Цинк - биометалл, входит в состав инсулина (гормона поджелудочной железы) и некоторых ферментов, например, карбоангидразы.
В виде простых веществ цинк, кадмий и ртуть - серебристо-белые металлы, ртуть при комнатной температуре находится в жидком состоянии.
| Свойства | Zn | Cd | Hg |
| Плотность, г/см3 | 7,1 | 8,7 | 13,55 |
| Т.пл., °С | -38,9 |
Металлический цинк в основном применяется для нанесения защитных покрытий (цинкование) и производства сплавов, основным из которых является латунь (медь + цинк). Значительное количество цинка используется для получения других металлов металлотермическим методом. Кадмий используют в атомной энергетике как поглотитель нейтронов (регулирующие стержни), а также для производства легкоплавких и типографских сплавов. Ртуть применяют в измерительных приборах, установках для собирания газов, электролизерах (жидкий катод), а также в металлургии для извлечения золота и серебра методом амальгамирования.
Цинк - довольно активный металл. При нагревании он легко окисляется кислородом, галогенами и другими неметаллами, образуя бинарные соединения:
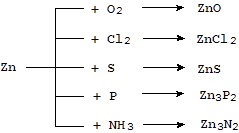
При температуре 150 °С цинк реагирует с парами воды с выделением водорода:
t
Zn + H2O = ZnO + H2
По отношению к неметаллам кадмий и ртуть напоминают цинк. Ртуть отличается большим сродством к сере и йоду, с которыми она реагирует уже при комнатной температуре. Азот, фосфор, углерод, кремний и бор с ртутью непосредственно не взаимодействуют. Ртуть растворяет многие металлы с образованием жидких или твердых сплавов - амальгам.
В ряду стандартных электродных потенциалов цинк и кадмий стоят левее водорода, поэтому они энергично растворяются в растворах кислот (кадмий менее активен). Ртуть в ряду стандартных электродных потенциалов стоит правее водорода, поэтому растворяется только в кислотах - окислителях по аниону, например:
Hg + 4HNO3(конц) = Hg(NO3)2 + 2NO2 + 2H2O
6Hg + 8HNO3(разб) = 3Hg2(NO3)2 + 2NO + 4H2O
Цинк, в отличие от кадмия и ртути, легко растворим в щелочах:
Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2
Цинк и кадмий образуют оксиды и гидроксиды, обладающие амфотерными свойствами (у соединений кадмия преобладают основные свойства), а также бинарные соединения с неметаллами. Оксид ртути обладает основными свойствами, термически нестоек:
t
2HgO = 2Hg + O2
Гидроксиды цинка и кадмия растворимы в аммиачных растворах за счет образования устойчивых координационных соединений:
Zn(OH)2 + 4NH3 = [Zn(NH3)4](OH)2
Гидроксид ртути неизвестен. При действии аммиака на другие соединения ртути обычно образуются амидные производные:
HgCl2 + 2NH3 = HgNH2Cl + NH4Cl
Для металлов подгруппы цинка известно большое число солей, из которых малорастворимы фториды, карбонаты (неизвестен для ртути), а также HgBr2 и HgI2. Цинк и в меньшей степени кадмий образуют координационные соединения как катионного, так и анионного типа.
Для ртути(I) описаны оксид - Hg2O (черного цвета), галогениды, например, Hg2Сl2 (каломель) и некоторые соли. Хорошо растворим нитрат ртути(I) - Hg2(NO3)2×2H2O, являющийся основным соединением при получении производных ртути(I). Производные катиона Hg22+ склонны к диспропорционированию:
Hg22+ = Hg2+ + Hg
Пары ртути и ее соединения чрезвычайно токсичны! Весьма ядовиты также соединения кадмия.
Литература: [1] с. 551 - 563, 599 - 608, [2] с. 550 - 554, [3] с. 585 - 602
Дата добавления: 2017-10-04; просмотров: 3059;











