Лекция № 28. Элементы VIIIB-подгруппы
Побочная подгруппа VIII-группы периодической системы химических элементов включает 9 элементов, объединенных вместе по геометрическим соображениям, о чем можно судить по их общим электронным формулам (без учета провала электрона):
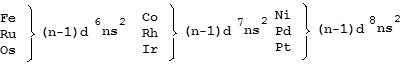
В то же время близость их электронных конфигураций к завершению d-подуровня обуславливает сходство свойств элементов данной подгруппы и их соединений. Кроме этого, внутри подгруппы наряду с вертикальной аналогией более или менее отчетливо проявляется аналогия у элементов одного периода, которые образуют семейство железа (Fe, Co, Ni), легкие платиновые металлы (Ru, Rh, Pd) и тяжелые платиновые металлы (Os, Ir, Pt). При этом сходство внутри данных семейств иногда просматривается более четко, нежели подобие в пределах группы электронных аналогов.
28.1. Элементы подгруппы железа
Железо один из наиболее распространенных металлов земной коры (2 мол.%). Основные минералы: Fe3O4 - магнетит, Fe2O3 - гематит, Fe2O3×nH2O - лимонит, FeCO3 - сидерит, FeS2 - пирит. Рутений и осмий самостоятельных минералов практически не образуют, обычно сопутствуют платине и палладию в полиметаллических рудах.
В промышленности железо и его сплавы (чугун) получают восстановлением оксидов железа оксидом углерода(II) при высоких температурах:
+ CO + CO + CO
Fe2O3 ¾® Fe3O4 ¾® FeO ¾® Fe
Очень чистое железо получают разложением его пентакарбонила:
t
Fe(CO)5 ¾® Fe + 5CO
Железо и рутений - серебристо-белые металлы, осмий - металл голубовато-белого цвета.
| Свойства | Fe | Ru | Os |
| Плотность, г/см3 | 7,87 | 12,37 | 22,61 |
| Т.пл., °С |
Основная область применения железа - это использование его в виде сплавов, преимущественно, чугуна и сталей. Чугун - сплав на основе железа с содержанием углерода в виде графита и цементита (Fe3C) выше 2%. Кроме этого, чугун может содержать примеси серы, фосфора, мышьяка, кремния и марганца. Специальные марки чугуна содержат значительное количество другого элемента: ферросилиций (12-14% кремния), ферромарганец (60-90% марганца), зеркальный чугун (12% кремния, 20% марганца). Стали - сплавы железа с содержанием углерода 0,1 - 2%. По химическому составу выделяют углеродистые и легированные стали (легирующие добавки других металлов придают стали новые технологические свойства). По назначению различают инструментальные, конструкционные и специальные стали. Рутений и осмий применяются в основном в виде сплавов с платиной для изготовления термопар и электрических контактов.
Химические свойства. Железо - металл средней химической активности. В компактном состоянии в атмосфере сухого воздуха устойчиво, во влажном воздухе корродирует. Примеси сильно ускоряют данный процесс. При нагревании до температуры белого каления железо энергично окисляется кислородом:
t
3Fe + 2O2 = Fe3O4
При высоких температурах окисляется галогенами и серой:
t + S + S
2Fe + 3Cl2 = 2FeCl3 ; Fe ¾® FeS ¾® FeS2
С фосфором, углеродом и кремнием железо образует соединения переменного состава (Fe3P, Fe2P, FeP, Fe3Si2, FeSi, FeSi2, Fe3C).
При повышенных температурах железо окисляется парами воды и аммиака:
800 °С t
3Fe + 4H2O ¾® Fe3O4 + 4H2; 4Fe + 2NH3 ¾® 2Fe2N + 3H2
В ряду стандартных электродных потенциалов железо стоит левее водорода:
Fe2+ + 2e- ¾® Fe; E0 = -0,44 B
Легко растворяется в водных растворах кислот с образованием солей железа(II). Концентрированная азотная и серная кислоты на холоду железо пассивируют, при нагревании реагируют с образованием солей железа(III).
Рутений и осмий химически инертны, в обычных условиях на них не действуют даже активные неметаллы. В мелкоизмельченном состоянии осмий окисляется кислородом с образованием летучего OsO4, рутений медленно окисляется при высокой температуре, образуя RuO2 и RuO4.
В компактном состоянии рутений и в меньшей степени осмий устойчивы по отношению к кислотам и их смесям, но разрушаются при сплавлении со щелочами в присутствии окислителей:
t
Ru + 3KClO + 2NaOH = Na2RuO4 + 3KCl + H2O
Соединения железа
Для соединений железа наиболее устойчивы степени окисления +2 и +3. Устойчивы соединения рутения(IV) и осмия(VIII).
Оксид железа(II) - черный диамагнитный порошок. В воде нерастворим, проявляет основные свойства:
FeO + 2HCl = FeCl2 + H2O
При нагревании на воздухе окисляется, сильными восстановителями (СО, Н2) восстанавливается до металлического железа:
+ CO + O2
Fe ¾ FeO ¾® Fe2O3
Гидроксид железа(II) - белое аморфное вещество, получаемое при действии щелочей на водные растворы солей железа(II). На воздухе быстро окисляется:
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
Fe(OH)2 - слабое основание с доминированием основных свойств.
Соли железа(II). Большинство из солей хорошо растворимы в воде и слабо гидролизованы, окрашены в бледно-зеленый цвет, в водных растворах легко окисляются кислородом воздуха:
2Fe2+ + O2 + 4H+ = 2Fe3+ + 2H2O
Качественной реакцией на катион Fe2+ является образование синего осадка (турнбулева синь) при действии гексацианоферрата(III) калия (красной кровяной соли):
Fe2+ + K3[Fe(CN)6] = KFe[Fe(CN)6]¯ + 2K+
Хлорид железа(II) применяется при лечении анемии. Желтая кровяная соль - K4[Fe(CN)6] - применяется в аналитической химии и при приготовлении красителей. Сульфат железа(II) применяется для борьбы с вредителями растений.
Оксид железа(III) - красный порошок, нерастворимый в воде, амфотерный оксид со слабым проявлением кислотных свойств. Гидроксид железа(III) - красно-коричневое аморфное вещество, выделяющееся при действии щелочей на водные растворы солей железа(III). Проявляет свойства амфотерного гидроксида:
Fe(OH)3 + 3HCl = FeCl3 + 3H2O
Fe(OH)3 + 3KOH = K3[Fe(OH)6]
Катион Fe3+ образует соли с анионами многих кислот. В водных растворах соли железа окрашены в желто-коричневый цвет и сильно гидролизованы. По этой причине соли железа(III) и слабых кислот нельзя получить в водных растворах:
FeCl3 + 3KCN + 3H2O = Fe(OH)3 + 3KCl + 3HCN
Качественными реакциями на соли железа(III) являются реакция с гексацианоферратом(II) калия (желтая кровяная соль) или тиоцианатом (роданидом) калия:
Fe3+ + K4[Fe(CN)6] = KFe[Fe(CN)6]¯ + 3K+
темно-синий осадок
Fe3+ + 3SCN- = Fe(SCN)3
кроваво-красный раствор
В отличие от солей железа(II), соли железа(III) проявляют свойства слабого окислителя и окисляют анионы некоторых кислот-восстановителей:
2FeCl3 + 6KI = 2FeI2 + I2 + 6KCl
FeCl3×6H2O применяется при лечении анемии, обладает кровоостанавливающим действием. Fe2(SO4)×9H2O используют как коагулятор при очистке воды.
Соединения железа(VI) представлены производными аниона FeO42-, которые получаются окислением оксида железа(III) в щелочной среде:
Fe2O3 + 3KNO3 + 4KOH = 2K2FeO4 + 3KNO2 + 2H2O
Тетраоксоферраты(VI) - сильные окислители, в растворах быстро разлагаются с выделением кислорода:
4K2FeO4 + 10H2O = 4Fe(OH)3 + 8KOH + 3O2
Железо играет важную роль в жизнедеятельности животных и человека. Входит в состав гемоглобина и миоглобина, а также некоторых ферментов. Наряду с серой входит в состав ферредоксинов - переносчиков электронов в биохимических процессах.
28.2. Элементы подгруппы кобальта
Кобальт довольно распространенный элемент земной коры, его кларк составляет 0,0015 мол.%. Кобальт образует небольшое число минералов, основным из которых является кобальтин (кобальтовый блеск) - CoAsS. Родий и иридий чаще всего встречаются в виде сплавов с осмием и платиной. В виде простых веществ кобальт, родий и иридий - блестящие белые металлы, кобальт с сероватым, родий и иридий - с серебристым оттенком.
| Свойства | Co | Rh | Ir |
| Плотность, г/см3 | 8,90 | 12,41 | 22,65 |
| Т.пл., °С |
Основное количество кобальта идет на производство твердых сплавов и сверхтвердых металлокерамических композиций. Порошок металлического кобальта применяется в качестве катализатора в реакциях гидро- и дегидрогенизации. Металлический родий и его сплавы с платиной применяются для изготовления термопар, в качестве катализатора и в ювелирной промышленности. Иридий также применяется в основном в виде сплавов с платиной или осмием (эталоны длины, кислотостойкая химическая аппаратура и пр.).
По химической активности кобальт несколько уступает железу. При обычной температуре компактный кобальт устойчив к действию сухого и влажного воздуха, воды, щелочей и разбавленных растворов органических кислот. Окисляется кислородом воздуха при 300 °С с образованием СоО, Со2О3 и Со3О4. При нагревании взаимодействует с галогенами, серой, углеродом:
t t
Co + F2 ® CoF2, CoF3 ; Co + Cl2 = CoCl2
t t
Co + S = CoS; Co + C = Co3C
С фосфором, мышьяком, кремнием и бором образует соединения переменного состава. Не реагирует с азотом, но при нагревании до температуры красного каления реагирует с аммиаком, сероводородом и водой.
По отношению к кислотам более устойчив по сравнению с железом, медленно растворяется в разбавленной соляной и серной кислоте, быстро - в разбавленной азотной кислоте, с образованием солей кобальта(II). Концентрированная азотная кислота кобальт пассивирует. Со щелочами кобальт практически не взаимодействует.
Родий и особенно иридий отличаются высокой химической инертностью. Родий окисляется кислородом при температуре 600 °С, а иридий - выше 1000 °С.
t t
4Rh + 3O2 = 2Rh2O3; Ir + O2 = IrO2
Компактные родий и иридий практически не растворяются ни в одной из кислот или их смесей.
Приближение электронной конфигурации к завершенной структуре обуславливает проявление элементами подгруппы кобальта невысоких степеней окисления. Для кобальта наиболее типичны степени окисления +2 и +3, для родия и иридия характерны соединения в степени окисления +3 и +4.
В степени окисления +2 кобальт образует оксид и гидроксид, основные свойства которых явно доминируют, а также галогениды, разнообразные соли и координационные соединения. Бинарные соединения и соли для кобальта(III) нехарактерны. Относительно устойчив Со3О4, являющийся смешанным оксидом СоО×Со2О3. Со(III) образует большое число катионных и анионных комплексов. Аквакомплекс [Co(H2O)6]3+ является сильным окислителем и окисляет даже воду:
[Co(H2O)6]3+ + e- ® [Co(H2O)6]2+ ; E0 = 1,81 В
Катионы кобальта(III) входят в состав витамина В12, играющего важную роль в процессе образования эритроцитов.
28.3. Элементы подгруппы никеля
Никель - довольно распространенный элемент земной коры, его кларк составляет 0,0032 мол.%, обычно содержится в сульфидных медно-никелевых рудах. Известно несколько самостоятельных минералов, из которых наибольшим содержанием никеля отличается миллерит - NiS. Палладий и платина, как и другие платиновые металлы, относятся к числу редких элементов. Платина встречается в самородном виде с примесями других металлов, палладий обычно сопутствует платине.
| Свойства | Ni | Pd | Pt |
| Плотность, г/см3 | 8,91 | 12,02 | 21,46 |
| Т.пл., °С |
Никель используется в основном для изготовления коррозионно-устойчивой посуды и аппаратуры, для нанесения защитных покрытий и в сплавах с другими металлами. Мелкодисперсный никель применяется как катализатор процессов гидрирования и дегидрирования углеводородов. Палладий и платина также широко используются в химической промышленности как катализаторы разнообразных процессов. Кроме того платина применяется для изготовления химической посуды, термопар и электрических контактов. В ювелирном деле применяются сплавы палладия с платиной или золотом.
По химической активности никель уступает железу и кобальту, он не корродирует в воде, на воздухе и в различных растворах. Кислородом окисляется при температуре выше 500 °С. При нагревании никель реагирует с галогенами и серой с образованием соответствующих бинарных соединений:
t t
Ni + Cl2 = NiCl2; Ni + S = NiS
При высоких температурах Ni реагирует также с фосфором, углеродом, кремнием и бором с образованием соединений переменного состава (твердых растворов). При 600 °С никель реагирует с водой:
t
Ni + H2O = NiO + H2
При незначительном нагревании взаимодействует с оксидом углерода с образованием тетракарбонила:
t
Ni + 4CO = Ni(CO)4
Разбавленные соляная, азотная и серная кислота медленно растворяют никель с образованием солей Ni2+. Концентрированная азотная кислота на холоду никель пассивирует. По отношению к щелочам никель устойчив.
По сравнению с другими платиновыми металлами палладий и платина более реакционноспособны. Однако в реакции они вступают в мелкодисперсном состоянии и при очень высокой температуре. Образующиеся при этом соединения нестойки и при дальнейшем нагревании разлагаются. Палладий отличается способностью растворять большое количество водорода (при 90 °С 1 объем Pd поглощает 900 объемов водорода).
Палладий довольно легко растворяется в концентрированных азотной и горячей серной кислотах. Платина растворяется только в царской водке при нагревании:
Pt + 4HNO3 + 18HCl = 3H2[PtCl6] + 4NO + 8H2O
Для соединений никеля и палладия наиболее характерна степень окисления +2, а для платины +4. Никель образует основной оксид и гидроксид никеля(II), а также сульфид, галогениды и разнобразные соли катиона Ni2+. Палладий образует оксид и гидроксид палладия(II), а также сульфид, галогениды и ограниченное число солей катиона Pd2+. Палладий(II) и платина(II) образуют большое число катионных и анионных комплексов.
Степень окисления +4 характерна для платины, которая образует бинарные соединения (оксид, сульфид и галогениды) а также амфотерный гидроксид - PtO2×nH2O с преобладанием кислотных свойств. Кроме этого платина(IV) образует большое число координационных соединений. Производные палладия(IV) малочисленны и являются окислителями.
Литература: [1] с. 650 - 679, [2] с. 540 - 550, [3] с. 548 - 584
Дата добавления: 2017-10-04; просмотров: 2278;











