Лекция № 27. Элементы VIВ и VIIВ-подгрупп (подгруппы хрома и марганца)
27.1 Элементы VIВ-подгруппы (подгруппа хрома)
Элементы VIВ-подгруппы: хром - Cr, молибден - Mo, вольфрам - W, электронные аналоги с ожидаемой электронной формулой (n-1)d4ns2. Однако у атомов хрома и молибдена за счет провала электрона реализуется конфигурация (n-1)d5ns1. Содержание в земной коре: Cr - 8×10-3, Mo - 6×10-5, W - 1×10-5 мол.%. Основные минералы: Fe(CrO2)2 - хромистый железняк, PbCrO4 - крокоит, MoS2 - молибденит, CaWO4 - шеелит.
Хром получают, восстанавливая его оксид алюминием или кремнием:
t
Cr2O3 + 2Al = Al2O3 + 2Cr
Молибден и вольфрам получают, восстанавливая их оксиды водородом:
t
WO3 + 3H2 = W + 3H2O
В виде простых веществ хром, молибден и вольфрам представляют собой серовато-белые металлы с высокой плотностью и температурой плавления:
| Свойства | Cr | Mo | W |
| Плотность, г/см3 | 7,2 | 10,2 | 19,3 |
| Т.пл., °С |
В обычных условиях химически весьма инертны. При нагревании сгорают в атмосфере кислорода:
t t
4Cr + 3O2 = 2Cr2O3; 2W + 3O2 = WO3
Реакции с серой и галогенами протекают более сложно:
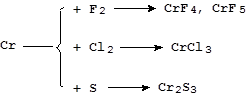
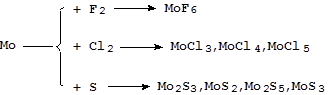
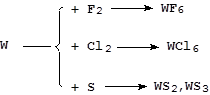
Реакции с азотом, фосфором, углеродом, кремнием и бором идут при высоких температурах с образованием соединений переменного состава - бертолидов.
В ряду хром - молибден - вольфрам наблюдается понижение химической активности, что иллюстрируется отношением металлов данной группы к кислотам. Хром растворим в соляной и разбавленной серной кислотах:
Сr + 2H+ = Cr2+ + H2
Концентрированные кислоты-окислители на холоду хром пассивируют. Молибден и вольфрам растворяются только в смеси плавиковой и концентрированной азотной кислоты при нагревании:
t
Mo + 2HNO3 + 8HF = H2[MoF8] + 2NO + 4H2O
В присутствии окислителей хром, молибден и вольфрам реагируют с расплавами щелочей:
t
2Cr + 3O2 + 4NaOH = 2Na2CrO4 + 2H2O
Раскаленные хром, молибден и вольфрам окисляются водой:
t t
2Cr + 3H2O = Cr2O3 + 3H2; W + 3H2O = WO3 + 3H2
Элементы подгруппы хрома способны проявлять все степени окисления от +1 до +6. Для молибдена и вольфрама наиболее устойчивы соединения в степени окисления +6, для хрома характерны степени окисления +2, +3 и +6.
В степени окисления +2 хром образует основной оксид - CrO, соответствующий ему гидроксид - Cr(OH)2 и соли. Все соединения хрома(II) - сильные восстановители, катион хрома(II) окисляется даже водой:
2CrCl2 + 2H2O = 2Cr(OH)Cl2 + H2
Степень окисления +3 для хрома наиболее устойчива и реализуется в оксиде - Cr2O3, гидроксиде - Cr(OH)3 и солях хрома(III). Оксид хрома(III) - темно-зеленый мелкокристаллический порошок, химически очень инертен. При сплавлении проявляет свойства амфотерного оксида:
t
Cr2O3 + 3K2S2O7 = Cr2(SO4)3 + 3K2SO4
t
Cr2O3 + 2KOH = 2KCrO2 + H2O
Гидроксид хрома(III) осаждается щелочами из водных растворов солей хрома(III) и представляет собой аморфное вещество серо-синего цвета, имеющее переменный состав Cr2O3×nH2O. Свежеосажденный гидроксид легко растворяется в растворах кислот и щелочей:
+ H+ + OH-
[Cr(H2O)6]3+ ¾ Cr(OH)3 ¾® [Cr(OH)6]3-
Соли катиона [Cr(H2O)6]3+ окрашены в фиолетовый цвет, выделяются из растворов в виде кристаллогидратов с большим содержанием воды: CrCl3×6H2O, Cr2(SO4)3×12H2O, K2SO4×Cr2(SO4)3×24H2O. Сульфат хрома и хромокалиевые квасцы широко применяются при выделке кож. Безводные соли хрома(III) имеют полимерное строение и в воде нерастворимы.
Степень окисления +6 реализуется в галогенидах, оксогалогенидах, оксидах хрома, молибдена и вольфрама и в некоторых анионных комплексах. Триоксиды - кристаллические вещества: CrO3 - красного цвета, MoO3 - белый, WO3 - желтый. Оксид хрома(VI) хорошо растворим в воде, образуя хромовую кислоту:
CrO3 + H2O = H2CrO4
Триоксиды молибдена и вольфрама в воде нерастворимы, но растворимы в щелочах, образуя соли:
MoO3 + 2KOH = K2MoO4 + H2O
Молибдаты и вольфраматы бесцветны, хроматы окрашены в желтый цвет. При подкислении раствора хроматы переходят в дихроматы и далее в полихроматы. В предельном случае из раствора выделяется оксид хрома(VI):
CrO42- + 2H+ = Cr2O72- + H2O
Переход обратим и при подщелачивании раствора вновь образуются хроматы:
Cr2O72- + 2OH- = 2CrO42- + H2O
Соединения молибдена(VI) и вольфрама (VI) явно выраженными окислительными свойствами не обладают. Хроматы и дихроматы - сильные окислители, при действии восстановителей восстанавливаются до соединений хрома(III):
K2Cr2O7 + 3NaNO2 + 4H2SO4 = Cr2(SO4)3 + K2SO4 + 3NaNO3 + 4H2O
K2Cr2O7 + 3NaNO2 + 4H2O = 2Cr(OH)3 + 2KOH + 3NaNO3
2K2CrO4 + 3NaNO2 + 2KOH + 5H2O = 2K3[Cr(OH)6] + 3NaNO3
Хром - одна из важнейших легирующих добавок, улучшающая физические свойства сталей и их устойчивость к коррозии. Благодаря устойчивости по отношению к агрессивным средам хром используется в качестве защитного покрытия (хромирование). Основное количество молибдена и вольфрама применяется в производстве легированных сталей. Молибденсодержащие стали используются для изготовления инструментов, валов турбин, броневых плит, стволов огнестрельного оружия. Вольфрамсодержащие стали характеризуются прочностью на истирание, устойчивостью к высоким температурам и химическим реагентам, пластичностью и упругостью.
Молибден - единственный элемент IV периода, относящийся к биометаллам. Входит в состав фермента нитрогеназа, играющего ключевую роль в процессе фиксации атмосферного азота клубеньковыми бактериями.
27.2. Элементы VIIВ-подгруппы (подгруппа марганца)
VIIВ-подгруппа включает марганец - Mn, технеций - Tc и рений - Re. Общая электронная формула (n-1)d5ns2 позволяет ожидать проявление всех степеней окисления от +1 до +7. Для марганца наиболее устойчивы соединения в степени окисления +2, +4 и +7. Для технеция и рения характерны степени окисления +4 и +7.
Марганец - довольно распространенный элемент земной коры, его кларк составляет 0,03 мол.%. Рений - редкий элемент (его кларк равен 8×10-9 мол.%). Технеций не имеет стабильных изотопов с большим периодом полураспада и встречается в земной коре в следовых количествах, получен искусственно. Минералы марганца: MnO2 - пиролюзит, Mn3O4 - гаусманит, Mn2O3 - браунит, Mn2O3×H2O - манганит. Основной минерал рения - CuReS4 - джезказганит.
Марганец получают восстановлением его оксидов алюминием или кремнием. Технеций получен облучением протонами молибдена-98:
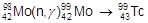
Рений получают восстановлением перрената аммония водородом:
t
2NH4ReO4 + 4H2 = 2Re + N2 + 8H2O
В виде простых веществ марганец, технеций и рений - металлы серебристо-белого цвета, с высокой плотностью и температурой плавления.
| Свойства | Mn | Tc | Re |
| Плотность, г/см3 | 7,3 | 11,5 | |
| Т.пл., °С |
Марганец довольно активный металл, особенно при повышенных температурах.
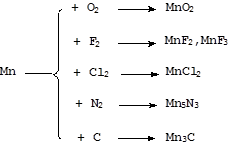
Чистый марганец устойчив к воде на при комнатной температуре и медленно реагирует с ней при нагревании. Примеси ускоряют данный процесс. Марганец, загрязненный углеродом, азотом и т.п., медленно реагирует с водой уже при комнатной температуре:
Mn + 2H2O = Mn(OH)2 + H2
В ряду стандартных электродных потенциалов марганец стоит левее водорода, поэтому легко растворяется в водных растворах кислот:
Mn + 2HCl = MnCl2 + H2
В растворах щелочей марганец в отсутствие окислителей устойчив.
В ряду марганец - технеций - рений химическая активность сильно уменьшается. Сгорая в атмосфере кислорода при нагревании, технеций и рений образуют оксиды в степени окисления +7:
t
4Tc + 7O2 = 2Tc2O7
Реакция с хлором приводит к образованию TcCl4 и ReCl5. Фтор реагирует с рением с образованием ReF6. По отношению к воде технеций и рений в обычных условиях устойчивы. Металлический технеций и рений растворяется в азотной кислоте, царской водке. Рений взаимодействует при нагревании с концентрированной серной кислотой, растворяется в щелочах в присутствии окислителей:
2Re + 7H2SO4 = 2HReO4 + 7SO2 + 6H2O
4Re + 4NaOH + 7O2 = 4NaReO4 + 2H2O
Оксид марганца(II) - MnO - зеленое кристаллическое вещество. Амфотерный оксид с явным преобладанием основных свойств, растворим в кислотах, в воде нерастворим. Кислотные свойства проявляются при сплавлении со щелочами или основными оксидами:
t
MnO + K2O = K2MnO2
При нагревании на воздухе окисляется:
t
2MnO + O2 = 2MnO2
Гидроксид марганца(II) - Mn(OH)2 - аморфный белый осадок, получающийся при действии щелочей на соли марганца(II):
Mn2+ + 2OH- = Mn(OH)2
В воде малорастворим, слабое основание. Легко взаимодействует с кислотами, со щелочами реагирует только при сплавлении или длительном нагревании:
t
Mn(OH)2 + 4OH- = [Mn(OH)6]4-
Легко окисляется кислородом:
2Mn(OH)2 + O2 = 2MnO2 + 2H2O
Описано большое число солей марганца(II), большинство из которых хорошо растворимы в воде. Малорастворимы MnF2, MnCO3, Mn3(PO4)2. Катион [Mn(H2O)6]2+ имеет слабую розовую окраску, такую же окраску имеют кристаллогидраты солей марганца(II). Все соли марганца(II) - сильные восстановители.
Основным соединением марганца(IV) является его диоксид - MnO2 - черно-бурое вещество, нерастворимое в воде, химически довольно инертное. MnO2 - амфотерный оксид с явным преобладанием кислотных свойств. Может проявлять свойства как окислителя, так и восстановителя:
t
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
t
3MnO2 + KClO3 + 6KOH = 3K2MnO4 + KCl + 3H2O
Соединения марганца(VII): оксид - Mn2O7, марганцевая кислота - HMnO4 и ее соли. Оксид марганца(VII) получается при действии концентрированной серной кислоты на перманганат калия:
2KMnO4 + 2H2SO4 = Mn2O7 + 2KHSO4 + H2O
Mn2O7 - темно-зеленая жидкость, крайне неустойчив, разлагается со взрывом. Типичный кислотный оксид, реагирует с водой с образованием марганцевой кислоты:
Mn2O7 + H2O = 2HMnO4
Марганцевая кислота - HMnO4 - сильная кислота, устойчива только в разбавленных растворах. Соли - перманганаты - более устойчивы, но при нагревании разлагаются с выделением кислорода:
t
2KMnO4 = K2MnO4 + MnO2 + O2
Перманганат-анион - сильнейший окислитель, глубина восстановления которого зависит от кислотности раствора:
MnO4- + 8H+ + 5e- ® Mn2+ + 4H2O, E0 = 1,58 В
MnO4- + 2H2O + 3e- ® MnO2 + 4OH-, E0 = 1,23 В
MnO4- + 1e- ® MnO42-, E0 = 0,56 В (при рН>7)
Основное количество марганца (чаще в виде сплава с железом - ферромарганца) применяется для раскисления чугуна и сталей. Стали с большим содержанием марганца (10-15 %) имеют большое сопротивление к удару и истиранию. Диоксид марганца применяется как катализатор и окислитель, KMnO4 применяется как окислитель и антисептик.
Марганец - биологически важный элемент, играет значительную роль в обмене веществ, влияет на процессы роста и размножения, а также кровообразования. Ускоряет образование антител, нейтрализует чужеродные белки. Внутривенным введением раствора MnSO4 удается спасти укушенных каракуртом. Важен марганец и для растений - ускоряет образование хлорофилла и витамина С. Повышает урожайность некоторых сельскохозяйственных культур, например, пшеницы и хлопчатника.
Рений используют в качестве добавки к сплавам и для изготовления электродов в рентгеновских трубках и радиолампах. Осаждением металлического рения получают зеркала с высокой отражательной способностью. Рений и его соединения применяют как катализаторы.
Литература: [1] с. 633 - 645, [2] с. 523 - 539, [3] с. 521 - 548
Дата добавления: 2017-10-04; просмотров: 2351;











