Сосудистые доступы для гемодиализа
Успешное, долголетнее лечение программным гемодиализом (ПГД) больных с терминальной стадией хронической почечной недостаточности (тХПН) в большей степени зависит от наличия адекватного сосудистого доступа.
Соответствующий доступ к сосудам является центральной проблемой длительного лечения больных с тХПН, поскольку он обеспечивает соединение больного с аппаратом «искусственная почка». Кровоток через диализатор аппарата должен быть адекватным, а для обеспечения эффективного диализа доступ «к крови» должен создавать техническую возможность проводить диализ трижды в неделю, фактически всю оставшуюся жизнь пациента или до приживления в его организме почечного трансплантата.
В настоящеее время существуют следующие методы сосудистого доступа.
Временные сосудистые доступы:
• артерио-венозные шунты (АВШ);
• катетеризация центральных вен (двухпросветные диализные катетеры, манжеточные силиконовые внутривенные катетеры (Tesioª, Permcathª, Ash Split Cathª), катетеры Cannonª II Plus из полиуретана и др.).
Постоянные сосудистые доступы (ПСД):
• нативная артерио-венозная фистула (АВФ);
• АВФ с использованием аутовен;
• АВФ с использованием алловен;
• АВФ с использованием синтетического сосудистого протеза.
Для имплантации артерио-венозного шунта используют a.radialis и v.cephalica в нижней или средней трети предплечья. В послеоперационном периоде, с целью профилактики тромбоза назначают гепарин по 2500ед 4 раза в сутки.
Сосудистые осложнения (тромбозы, инфекции и кровотечения) у больных, находящихся на лечении ПГД с наружными АВШ, встречаются очень часто.
Все эти осложнения значительно ухудшают состояние больного, удлиняют сроки лечения, увеличивают его стоимость, снижают результаты диализной терапии и пересадки почки.
В последние годы для проведения острого гемодиализа при ОПП и при невозможности или нецелесообразности формирования ПСД у определенной категории пациентов с тХПН применение двухпросветных диализных катетеров, манжеточных силиконовых внутривенных катетеров (рис. 19.1.5) является оправданным, а во многих случаях и единственно приемлемым. Однако только около 30-40% манжеточных катетеров остаются функционально пригодными через 1 год. Кандидатами для постановки манжеточных внутривенных катетеров могут рассматриваться только пациенты, у которых невозможно сформировать ПСД или проводить заместительную терапию методом перитонеального диализа.
Преимуществом применения этих катетеров является тот факт, что сохраняются артерии и вены конечностей для дальнейшего формирования АВФ. Также следует учесть малоинвазивность метода для проведения экстракорпоральной детоксикации, устранение артерио-венозного сброса, который усугубляет явления сердечной недостаточности и простоту их имплантации по методу Seldinger S.I. (1953). Применение этих катетеров предупреждает развитие большого количества гнойно-септических осложнений, что создает возможность формирования АВФ в условиях отсутствия гнойных ран и развившегося тромбоза сосудов конечностей.
Катетеризацию центральных вен производят при необходимости проведения экстренного гемодиализа, например, при быстром нарастании симптомов уремии, развитии гипергидратации, гиперкалиемии и отсутствии АВФ.
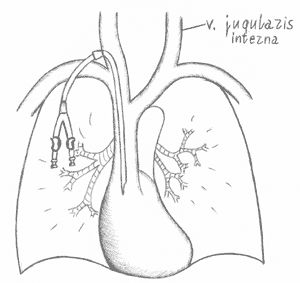
Рисунок 19.1.5.Стандартное положение туннельного катетера в правом предсердии
Все таки, большое количество различных осложнений (тромбозы, нагноения и кровотечения) вплоть до смертельных исходов, необходимость длительного (многолетнего) лечения больных гемодиализом требует более совершенных форм создания сосудистых доступов. Одним из них является способ формирования различного вида АВФ.
Основными условиями для формирования длительно функционирующих АВФ являются: правильный выбор места и своевременность проведения операции, высокая микрохирургическая техника и определение периода времени между формированием АВФ и ее использованием (рисунок 19.1.6).
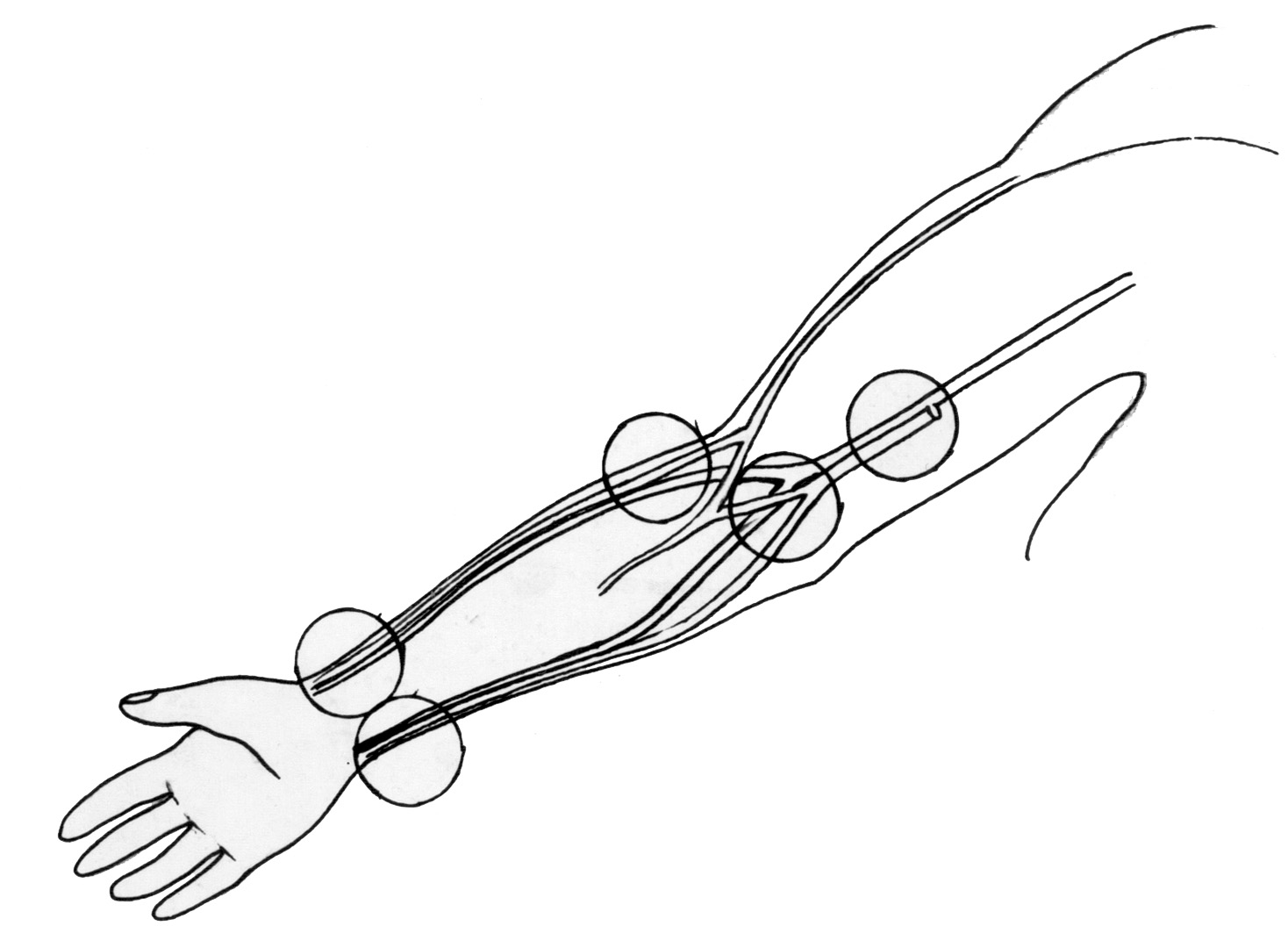
Рисунок 19.1.6. Возможные хирургические участки для формирования АВФ
При формировании нативных АВФ используют недоминантную руку и те же сосуды в нижней или средней трети предплечья. Под местной анестезией или внутривенным наркозом через один косой разрез выделяют a.radialis и v.cephalica на протяжении 3-4см, коллатерали, отходящие от основного ствола, легируют. Дистальные концы сосудов перевязывают и пересекают, в проксимальный конец вводят гепаринизированный раствор с целью профилактики тромбоза во время оперативного вмешательства, и с помощью специальных инструментов, с использованием нерассасывающегося атравматического шовного материала №6,0; 7,0; 8,0, накладывают анастомоз по типу «бок в бок», «конец в бок» или «конец в конец» (рисунок 19.1.7). В послеоперационном периоде больные получают гепарин в течение 7-10 дней и через 1-2мес артериализованную вену пунктируют специальными диализными иглами для соединения с магистралями аппарата «искусственная почка».
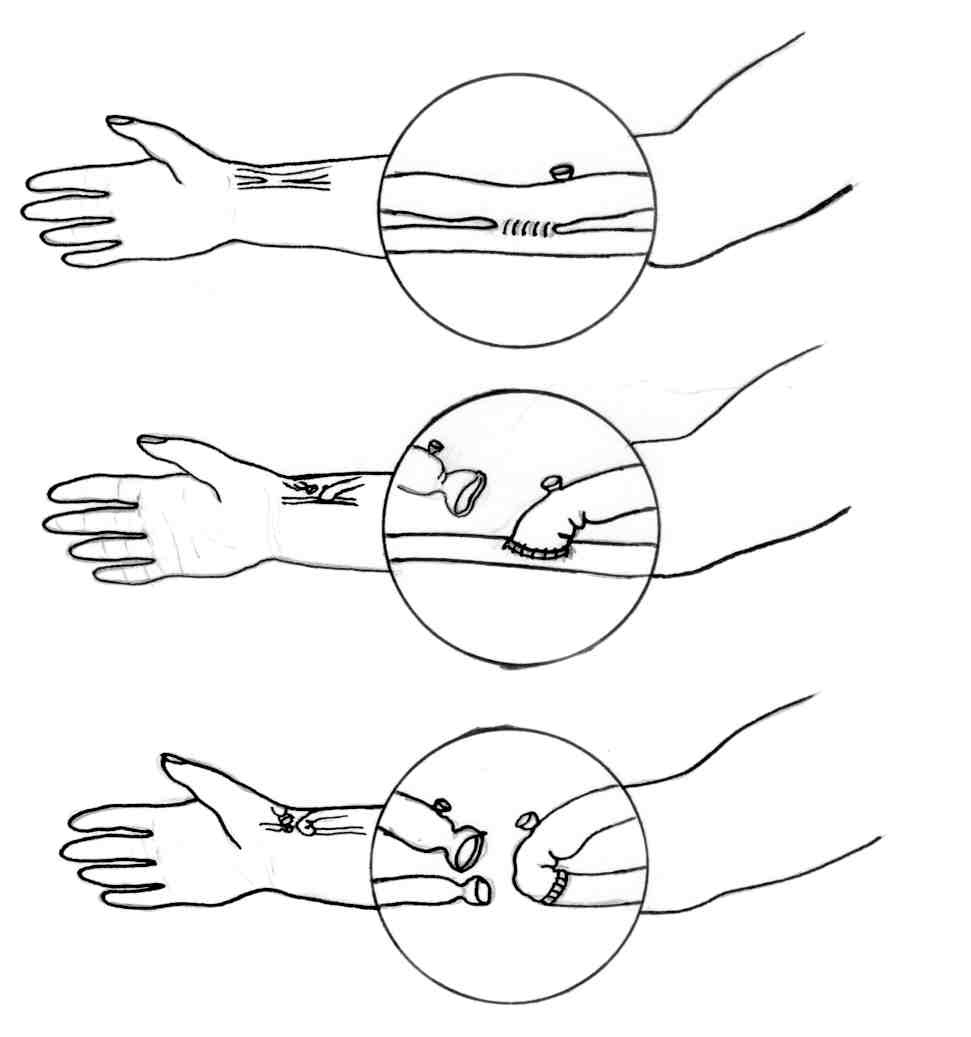
Рисунок 19.1.7. Варианты формирования артерио-венозных анастомозов и АВФ на сосудах предплечья (А.М.Шепетов, 1998).
Таким образом, количество осложнений при использовании нативных АВФ по сравнению с использованием АВШ значительно меньше, 20% и 47% соответственно. С целью уменьшения количества осложнений, улучшения условий проведения лечения гемодиализом, больным с тХПН рекомендуется раннее формирование АВФ на типичном месте.
Методы антикоагуляции.
Во время гемодиализа кровь выходит в экстракорпоральный контур, состоящий из игл, кровопроводящих магистралей с воздушной ловушкой и диализатора, что приводит к активации тромбоцитов и плазменных факторов свертывания. Поэтому антикоагуляция является обязательным компонентом диализа. Методы антикоагуляции включают системную гепаринизацию, инфузию простациклина или регионарную цитратную антикоагуляцию [22].
Основной метод антикоагуляции – системная гепаринизация. Механизм антикоагулянтного действия гепарина заключается в торможении активности тромбина, который катализирует превращение фибриногена в фибрин в системе гемостаза. Гепарин тормозит тромбообразование, способствуя инактивации тромбина его физиологическим ингибитором антитомбином III. В таблице 19.1.3 приведены рекомендации по использованию гепарина в зависимости от наличия/отсутствия риска кровотечения.
Существует 2 метода введения гепарина:
1) постоянная непрерывная инфузия с минимальным болюсом в начале диализа,
2) периодический болюс гепарина.
При наличии гепариновой помпы в аппарате «ИП» более предпочтительным является постоянная инфузия, так как это позволяет добиться адекватной управляемой антикоагуляции с меньшим риском кровотечения и более быстрой инактивацией гепарина при окончании диализа. Рекомендуемые дозы введения гепарина представлены в таблице 19.1.3.
Таблица 19.1.3. Рекомендации по использованию гепарина на гемодиализе
(John T. Daugirdas, Handbook of dialysis, 2001)
| Нефракционированный гепарин | Постоянная инфузия | Болюсное введение | |
| Без риска кровотечения | Риск кровотечения | Без риска кровотечения | |
| в/в болюс в начале диализа[ME/кг] | 20-30 (1500- 2000) | 0-10 (0-500) | 50-60 (4000-5000) |
| Продолженная инфузия [МЕ/кг/ч] | 10-20 (750-1500) | 5-10 (250-500) | Повторный болюс через 2ч |
| Целевой уровень удлинения активированного времени свертывания (АВС) от исходного в сек и [%] | 220-240сек 80% | 140-160 | 220-240сек 80% |
| Целевой уровень АЧТВ, сек | 70-80 | 70-80 |
Контроль за адекватностью антикоагуляции осуществляется как клиническими методами: визуальный осмотр экстракорпорального контура, разность давлений на входе и выходе диализатора и кровопроводящих магистралей, а также лабораторной оценкой свертываемости крови (табл. 19.1.4).
Таблица 19.1.4. Предраспологающие факторы и признаки тромбоза крови в экстракорпоральном контуре
| Факторы, способствующие свертыванию крови в экстракорпоральном контуре |
| - Низкая скорость кровотока - Высокий гематокрит - Высокий уровень ультрафильтрации - Рециркуляция в доступе - Инфузия крови или компонентов крови во время диализа - Инфузия жировых растворов в процессе диализа - Наличие воздушных ловушек (экспозиция с воздухом, пенообразование, турбулентное движение крови) |
| Признаки сгущения крови в экстракорпоральном контуре |
| - Чрезмерно темная кровь - Темные участки или полосы в диализаторе - Образование пены с последующим формированием тромба в венозной ловушке - Быстрое заполнение кровью линий датчиков давления - Маятникообразное движение крови в сегменте между диализатором и венозной ловушкой - Наличие сгустков в артериальном конце диализатора |
Антидотом гепарина является протамин сульфат, доза введения которого зависит от многих факторов (дозы и времени гепарина, показателей АВС и АЧТВ и т.д.).
К побочным эффектам гепарина относятся: повышенная кровоточивость, зуд, остеопороз, дислипидемия, гепарин индуцированная тромбоцитопения. Альтернативой гепарина при развитии таких осложнений может служить низкомолекулярный гепарин (НМГ), к которому относятся надропарин кальций, эноксипарин.
Процедура гемодиализа. Контроль адекватности процедуры[22].
При проведении процедуры гемодиализа следует учитывать следующие параметры:
• Скорость кровотока. Чем быстрее кровь поступает в экстракорпоральный контур, тем быстрее очищается организм и в диализатор поступает больший объем крови. Средняя рекомендуемая скорость установки насоса крови 5мл/кг/мин (напр., вес-70кг, кровоток-350мл/мин). Таким образом, весь ОЦК пациента проходит через диализатор порядка 20раз за 1 процедуру (4часа). Такую скорость можно добиться лишь при наличии адекватного сосудистого доступа – артерио-венозной фистулы.
• Длительность. Чем дольше длится диализ, тем лучше очищается организм от уремических токсинов. Почки здорового человека работают 24часа в сутки, ежесекундно фильтруя конечные продукты азотистого обмена. Минимально рекомендуемая длительность процедуры гемодиализа при адекватной скорости кровотока (не менее 300мл/мин) – 4часа. Недавние исследования показывают, что увеличение длительности диализа на 30мин уменьшает смертность пациентов на 15%. Наилучший показатель выживаемости пациентов зафиксирован в округе Тассин (Франция), где проводят ночной 8-часовой гемодиализ. У 80% пациентов с этого региона не было необходимости в применении антигипертензивных и фосфор-связывающих препаратов. Кроме того, при такой длительности диализа, как ни странно, зафиксировано наименьшее количество осложнений, связанных с самой процедурой диализа (синдиализная гипо-, гипертензия, кровотечение).
• Частота проведения. Опять же, если проводить аналогию с почками, клиренс происходит ежедневно. Следовательно, чем чаще проводится гемодиализ, тем лучше очищение организма. При ежедневном проведении гемодиализа (6 раз в неделю) длительность процедуры можно уменьшить до 2,5-3часов. Наименьшая частота кардиоваскулярных заболеваний зафиксирована у пациентов на ежедневном ночном 8-часовом гемодиализе. Минимально рекомендуемая частота проведения диализа – 3раза в неделю по 4 часа при адекватной скорости кровотока.
• ультрафильтрация. При развитии 5стадии ХБП, в особенности, у пацентов на гемодиализе, постепенно развивается олигоанурия. Сам диализ подразумевает собой удаление жидкости, в норме выводимой почками. Принципиальное различие гемодиализа от перитонеального диализа в зеркальных исходах в зависимости от объема ультрафильтрации. При перитонеальном диализе малый объем ультрафильтрации (менее 750мл/сут) сопряжен с высокой смертностью, тогда как на гемодиализе, наоборот, высокий объем ультрафильтрации (более 4,8% от массы тела за процедуру, например, вес 60кг, УФ-3л и более) увеличивает смертность. Важно постоянно проводить беседу с пациентами о необходимости в ограничении приема соли и соленых продуктов (копчености, консервы, полуфабрикаты), а также соблюдения водного режима.
Рекомендации Европейского руководства по лучшей клинической практике диализного режима (2007):
• Диализ должен проводиться как минимум 3 раза в неделю, с общей продолжительностью сеансов не менее 12 часов в неделю, даже в том случае, когда имеется остаточная функция почек.
• Увеличение продолжительности и/или частоты сеансов может потребоваться для пациентов с гемодинамической или сердечно-сосудистой нестабильностью.
• Продолжительность и/или частоту сеансов диализа следует увеличивать, если у пациента сохраняется АГ, несмотря на максимально возможное выведение жидкости.
• Увеличение продолжительности и/или частоты сеансов может потребоваться для пациентов с неконтролируемым нарушением фосфорного обмена.
• Увеличение продолжительности и/или частоты сеансов может потребоваться для пациентов с нарушением питания.
Контроль адекватности гемодиализа.
Маркером для контроля адекватности гемодиализа служит мочевина. Мочевина вырабатывается печенью из азота аминокислот через аммиак, что является основным путем выведения азотистых шлаков из организма. Генерация мочевины происходит пропорционально разрушению белка или темпу появления белка. Кроме того считается, что мочевина распределена в общей воде тела, как во внеклеточной, так и внутриклеточной жидкости. Поэтому степень удаления мочевины позволяет оценить адекватность диализа. Креатинин в данном случае не может служить надежным маркером, так как не распределен равномерно по жидкостным пространствам организма.
Формулы расчета адекватности диализа.
Наиболее простой и вместе с тем эффективной формулой оценки диализа служит вычисление доли снижения мочевины (ДСМ).
ДСМ=(мочевина до ГД – мочевина после ГД)/мочевина до ГД*100
Диализ считается адекватным, если ДСМ равен или выше 65%.
Более точно оценить качество диализа можно посредством расчета Kt/V. Эта формула представляет собой отношение, отражающее клиренс мочевины, где К – клиренс диализатора по мочевине крови, в литре/час; t – проложительность процедуры, час; V – объем распределения мочевины, литр. Есть несколько способов, которые позволяют вычислить значение Kt/V. Математический способ использует формулу Даугирдаса:
Kt/V= - ln(R - 0.008 × t) + (4 - 3.5 × R) × UF/W
ln - натуральный логарифм
R - мочевина после ГД/ мочевина до ГД
t - продолжительность гемодиализа в часах
UF - объем ультрафильтрации в литрах
W - вес пациента после гемодиализа в кг
Проведенные исследования показали более высокую смертность пациентов при Kt/V менее 1,2. Большинство диализных центров стараются достигать показателей Kt/V в пределах 1,4-1,6. В нашей стране минимально допустимым считается уровень 1,2. Неудобство математического расчета связано необходимостью забора крови для проведения лабораторного анализа. Немаловажен и человеческий фактор: требуется строго соблюдать технику, место и время забора крови по окончании гемодиализа для правильного вычисления Kt/V, что бывает не всегда возможно при большой загруженности диализного центра.
Все современные аппараты «ИП» измеряют Kt/V в режиме реального времени (онлайн), позволяя при необходимости проводить коррекцию при проведении гемодиализа. Например при низком фактическом Kt/V аппарат «ИП» будет указывать на необходимое дополнительное время диализа для достижения заданного уровня. Это, в принципе, невозможно при математическом вычислении. При сравнении обоих методов, разница составила менее 5%, что делает онлайн измерение Kt/V самым популярным методом оценки адекватности гемодиализа у нефрологов.
Дата добавления: 2017-10-04; просмотров: 8220;











