Глава 2. Производные галогенов.
В1997 году автор поступил в НГУ
и испытывал тяжкие душевные муки
по поводу физической химии.
Но произошла история, о которой вы узнаете ниже!
2.1. Понятие галогенидов. Простыми (бинарными) галогенидами называют соединения галогенов с каким-либо элементом, в которых галогены проявляют отрицательную степень окисления и имеют формальный заряд -1. Следует помнить следующие тривиальные требования. Все бинарные (двухэлементные) соединения с фтором – фториды. Все соединения хлора, кроме производных фтора, кислорода и азота – хлориды. Для брома, этот список дополняется хлором, для йода – также и бромом. Иодиды астата должны существовать, но химия этого элемента из-за высочайшей его радиоактивности, изучена плохо. С серой йод образует соединения, но степень его окисления в них неясна. Вполне вероятно, что полученные S2I2 и SI2 могут иметь и обратную полярность связи. Если исходить из метода Полинга определения электроотрицательностей, то энергия связи S-I равна ~ 0, что свидетельствует о крайне слабом обобществлении электронов и зарядах на атомах практически равных нулю. Сами соединения, которые бы следовало назвать иодидами (во всяком случае, следуя традиции и руководствуясь реакцией H2S + I2 → 2HI + S), получают по обменным реакциям из хлоридов серы и иодидов щелочных металлов в четыреххлористом углероде. Астат однозначно образует сульфид At2S. За исключением вышеописанных случаев, все соединения остальных элементов с галогенами – галогениды. Ионы вида F-, I- называю соответствующими галогенид-ионами – фторид, иодид. Общим обозначение галогенов является символ Hal.
2.2 Название галогенидов. Чтобы назвать какой-нибудь галогениду, необходимо назвать латинское числительно, равное числу атомов галогена, галоген с окончанием ид и название элемента в родительном падеже. Например, трифторид алюминия AlF3. Допустимо и обратное прочтение – алюминия трифторид. Если элемент образует только одно соединение, то можно говорить, не употребляя числительного – например, хлорид магния MgCl2. Если элемент образует несколько галогенидов, то можно применять два способа – указывая через числительное или говоря галогенид элемента (степень окисления). Например, хлорид железа (III) FeCl3. Произносится по-русски, но цифра в скобках – латинская. Димеры соединений, как правило, особых названий не имеют, как например хлорид алюминия, настолько сильная кислота Льюиса, что он образует кислотно-основное соединение сам с собой (рис. 1, стрелочками показаны донорно-акцепторные связи)

Рис. 1 Хлорид алюминия (плоская проекция).
Для галогенидов в низшей, нехарактерной степени окисления, используют термин субгалогенид. Примером может служить субхлорид алюминия AlCl. Как правило, эти вещества неустойчивы. Субхлорид алюминия существует только при высокой температуре и при охлаждении диспропорционирует на металл и трихлорид.
Кроме того, существует русскоязычная номенклатура, связанная с устоявшимися терминами еще времен Менделеева и ранее. Это закисно-окисная система. В случае, если элемент имеет две характерные степени окисления, то галогенид в высшей степени окисления называется галогенидом окисного элемента или галогенным элементом, в низшей – галогенидом закисного элемента и галогенистым элементом. Примером являются хлорное железо, хлорид окисного железа FeCl3 и хлористое железо, хлорид закисного железа FeCl2.
Существует также термин галиды, означающий тоже, что и галогениды.
2.3 Комплексные галогениды. Катионные комплексные галогениды, как правило, не имеют собственных названий, за исключением ониевых форм, приводимых в дальнейшем тексте. Анионные формы строятся по следующему принципу. Называется число атомов галогена, название галогена, затем идет название элемента + окончание –ат. Буква «о» как переходная между названием галогена и элемента вводится, если название элемента начинается на согласную – гексафторалюминат [AlF6]3- и гексафторосиликат [SiF6]2-, к примеру, Na3AlF6 – натрия гексафторалюминат. Степень окисления центрального атома указывают только в тех случаях, когда имеется несколько анионных форм одного состава, но в разных степенях окисления. Сложные случаи рассматриваются в приложении к конкретным элементам. Приведем таблицу 1, в которой сведем все случаи элементов, в которых центральный атом входит в состав аниона и имеет не тривиальное название. Эту таблицу следует знать, она всеобщая.
Таблица 1. Чтение анионов.
| Элемент | Чтение в анионе | Элемент | Чтение в анионе |
| C | Карбонат* | O | Оксигенат*** |
| Si | Силикат | S | Сульфат* |
| Sn | Станнат | Fe | Феррат |
| Pb | Плюмбат | Cu | Купрат |
| N | Нитрат* | Ag | Аргентат |
| P | Фосфат | Au | Аурат |
| As | Арсенат | Hg | Гидраргират/меркурат**** |
| Sb | Антимонат/стибат** | Ni | Никелат***** |
* - соответствующие анионные формы для галогенов неизвестны
** - антимонат – исторически сложившийся термин, в современной литературе встречается термин стибат.
*** - фтороксигенаты содержат группировку OF, это довольно узкая группа соединений в органической химии, в неорганической известно всего два таких вещества.
**** - восхождение разночтений связано с алхимическим соотнесением ртути с Меркурием. Но, поскольку ртуть была известна до алхимиков, название ее солей в анионных комплексах более правильно произносить как гидраргираты.
***** - строго говоря, в иностранных языках, в которых в названии никеля мягкий знак никоим образом не фигурирует (никель – cupfernickel, медь святого Николаса), возможно только прочтение через ат. В русском языке, в силу его структуры, проскакивает –ят, но ат правильнее.
Выше мы упомянули про алюминат. Как строится его название, ведь он не входит в число элементов с латинским происхождением названия? В этом случае отсекается окончание –ий и заменяется на –ат. При окончании на а, сдвоенная «аа» проглатывается – платинат.
2.4 Производные водорода. Соединения с водородом называются галогеноводородами, или как еще называют галогенводородами (галогенистыми водородами). Если говорить о частных случаях конкретного галогена, то всегда произносится через «о» - например, HF – фтороводород. Растворы галогенводородов в воде называются галогеноводородными или галогенистоводородными кислотами. Продажный раствор фтористоводородной кислоты HF, содержащий 40% массовых, называют плавиковой кислотой. Так можно говорить и более и менее концентрированных растворах. Высококонцентрированные растворы HF (в отличие от более тяжелых аналогов ее растворимость в воде не ограничена) – это растворы воды в кислоте, но такой термин применяют редко (это верно и для всех не ограничиваемо смешивающихся жидкостей). Концентрированные растворы соляной (HCl), бромоводородной и йодистоводородной кислот содержат приблизительно 37, 47 и 57% массовых вещества соответственно. Полимеры фтороводорода (HF)n, где n = 2 – 6, особых названий не имеют, сама запись практически не используется, но сильные водородные связи в этой жидкости, дотянули свои «волосатые щупальца» вплоть до литературы 70-х годов прошлого столетия. Так что встретите H2F2 в старой литературе – не удивляйтесь, но знайте – обычно это запись чистого фтороводорода, а не его водного раствора!
Сильные водородные связи в HF приводят к образованию кислых фторидов или гидрофторидов. Например, KHF2 – калия гидродифторид, KH2F3 – калия дигидротрифторид. Расплав эквимолярной смеси этих солей служит для получения фтора. Другие гидродигалогениды получены в незначительном количестве для наиболее крупных катионов, например, осадка (в водном растворе) цезия гидродибромида CsHBr2. Растворимые соли фактически нацело гидролизуются. Существует и катион дигидрофторония [H2F]+, известный только в растворах сильных акцепторов фторид-ионов в HF, например пентафторида сурьмы. Эти растворы относят к классу суперкислот, т.е. веществ, чья кислотность намного выше, нежели водные растворы кислот. Впрочем, мы здесь не будем на этом подробно останавливаться.
2.5 Межгалоидные соединения.Соединения галогенов между собой называются межгалоидными. Для хлора, брома и йода устойчивость монофторидов падает, а пентафторидов растет. Гептафторид йода IF7 сравнительно устойчив, соединение брома было сначала получено в виде катиона гексафторбромония BrF6+. Соли аналогичного катиона известны и для хлора. Трифторид брома – сильный аутоионизирующий растворитель. В чистом виде он незначительно диссоциирован
2BrF3 ↔ BrF2+ + BrF4-
Фториды элементов ведут себя по отношению к нему по-разному. Те, которые увеличивают концентрацию иона дифторбромония BrF2+ - это кислоты, тетрафторобромат-иона BrF4- – основания. Например, монофторид серебра AgF – основание, трифторид золота AuF3 – кислота. Между ними возможна реакция нейтрализации
AgBrF4 + BrF2AuF4 → AgAuF4 + 2BrF3
Тетрафтораурат (III) серебра выделяется в виде желтого порошка при отгонке растворителя. Аналогично тетрафтороброматам известны гексафтороброматы и гексафториодаты. Катионные формы здесь малоустойчивы.
Из других межгалоидных соединений получены монохлориды, монобромид и трихлорид йода. Им соответствуют тетрахлориодаты (III), дихлориодаты (I), дихлорброматы и дибромиодаты. В литературе встречается также тетрабромид ксенона, который, вероятнее всего, получается радиохимически из аниона [IBr4]-, далее мы еще коснемся вопросов верификации соединений. Важное замечание следует сделать о ICl. Вообще говоря, он существует в двух кристаллических формах α и β, например, α-ICl, т.е. обладает полиморфизмом.
2.6 Полигалогениды. Спиртовая настойка йода на самом деле представляет собой не раствор йода в этаноле, а раствора полиодида калия KI3. Это сравнительно узкий класс соединений щелочных металлов, в которых ион йода I- связан через d-орбитали с соседями. I3- изоструктурен линейному ICl2-; I5-, I7- и I9- имеют разветвленное строение.
2.7 Халькогены. 2.7.1 Производные кислорода. Здесь следует обратить внимание на фториды кислорода (остальные элементы образуют оксиды). Для дифторида кислорода OF2 нет никаких особенностей, но уже монофторид дает нам пищу для размышлений. Его структура
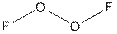
Рис. 2 Дифторид дикислорода
Поэтому его правильное название дифторид дикислорода (всего фторидов OnF2, известно 6, n = 1 - 6). Но это частная история. Так в трихлориде алюминия, сильной кислоте Льюиса, каждая группа выступает и как кислота и как основание. Его структурная формула сдвоенный тетраэдр (рис. 1).
Тем не менее, его формула во всей литературе AlCl3 и название трихлорид. Аналогичные соединения дают среди металлов железо, среди галогенов – бром.
Известна целая серия дифторидов поликислорода OnF2, где n = 2 – 6. Эти соединения так и называют, например дифторид трикислорода O3F2.
Сложное соединение фтороксигенат водорода HOF называют фторноватистой кислотой, хотя распределение зарядов в нем не соответствует аналогичным производным более тяжелых галогенов. Фтороксигенильная группа OF входит в состав как минимум двух неорганических и множества органических, полностью фторированных соединений. Неорганические производные: фторонитрат (диоксофтороксигенат азота) NO3F и перхлоратфторид ClO4F (назовите его). О веществах типа метфорилфторида кислорода CF3OF мы поговорим в другом разделе.
2.7.2 Сера. Сера образует целую серию фторидов. Это гексафторид SF6 (тривиальное название элегаз), декафторид дисеры S2F10, тетра- и дифториды, а также монофторид не выясненного строения – или это аналог оксосульфида серы S=S=O, или же это представитель галогенсульфанов. Хлор образует с серой тетра и дихлорид, а также хлорсульфаны цепочечного строения и состава SnCl2, где n = 2 – 23. Простейший из них – монохлорид серы, остальные называют по латинскому числу атомов, например хлорпентасульфан S5Cl2. Бром образует дибромид и бромсульфаны с числом атомов серы до 8. Известен пентафторохлорид серы SClF5, это достаточно типовой реактив, его можно купить в газовом баллоне не очень большого, правда, размера (куда он вам в баллоне как для углекислоты или нестандартном и неподъемном (150 кг) кислородном не очень понятно). Собственно это соединение и нужно только для весьма эстетских синтезов в органической химии. Данный пример дает нам правило названий тройных соединений, в которых галогены не связаны между собой, но обобщены центральным атомом. Вопросы йода и астата мы обсудили ранее.
2.7.3. Селен, теллур, полоний. Среди этих элементов известны тетрафториды и гексафториды. Существует и Te2F10 (назовите его). Получены все тетрагалогениды полония, но тетраиодид ни для селена, ни для теллура неизвестен. Из низших галогенидов синтезированы хлориды и бромиды теллура и полония (II). Для селена известны хлориды и бромиды (I), изоструктурные производным серы. Для селена известны гексахлорселенаты (IV), например калия K2SeCl6 и такие же броматы, гексафторид теллура с фторидами щелочных металлов образует гепта- и октофторотеллураты.
2.8. Пниктогены. 2.8.1 Азот. Азот электроположителен только ко фтору и образует серию фторидов. Это трифторид NF3, тетрафторгидразин N2F4, дифтордиимин N2F2 и фторазид N3F. Дифтордиимин должен был бы два соединения – транс- и цис-дифтордиимин. В первом (рис. 3а) атомы фтора лежат по разные стороны связи N=N, во втором (рис. 3б) ниже/выше связи, по одну сторону.
а) 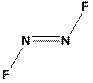 б)
б) 
Рис. 3 Дифтодиимины а) транс б) цис
Цис-транс-изомерия имеет важнейшее значение в органической химии. Методами квантовой химии, с которыми вы ознакомитесь на 3-м курсе показано, что цис-изомер не существует.
Фторазид – исторически неверное название, но оно закрепилось в литературе. Кроме бинарных соединений, известны соли катиона тетрафтораммония [NF4]+ с фторсодержащими комплексными анионами.
Исторически неверны и названия галогенид азота начиная с хлора. Это нитриды состава Hal3N. Нитрид хлора известен в свободном состоянии, брома только в виде гексааммиаката Br3N·6NH3, нитрид йода получается в смеси с йодамидом (это и аналогичные названия происходят из органической номенклатуры) NH2I и йодимидом NHI2. Обычно гремучий азот или йод, тут могут быть местные вариации, используют в шутейных целях (он хорошо взрывается под ногами при пробежке буйных студентов на посвящении), но приготовленный в полупромышленных количествах и выложенный для просушки на подоконнике, при изрядном солнечном нагреве, дополненном снизу батареей отопления, приводит комнату в общежитии на 10 квадратных метров, в негодность.
В противоположность им аналогичные производные фтора носят названия фторамин и дифторамин (фторимин), что связано с обратной полярностью связей. Среди моноазидов наиболее устойчиво соединение йода, наименее брома. Известен и азид йода (III) I(N3)3.
2.8.2 Фосфор, мышьяк, сурьма, висмут. Для всех элементов известен простой пентафторид и соли комплексных кислот – гексафторофосфаты, арсенаты, антимонаты (употребляют и более новый термин - стибаты), висмутаты. Раствор пентафторида сурьмы во фторсульфоновой кислоте HSO3F называют магической кислотой. Это самая кислая из всех известных систем. Твердый пентахлорид фосфора представляет собой гексахлорофосфат тетрахлорфосфония [PCl4]+[PCl6]-, соединение мышьяка известно только в форме гексафторарсената тетрахлорарсония [AsCl4]+[AsF6]-, пентахлорид сурьмы образует гексахлорантимонаты [SbCl6]-. Катион в пентбромиде фосфора устроен и называется аналогично хлориду, но противоионом ему служит бромид-ион. Пентабромид сурьмы известен в виде комплексного аниона (назовите его и напишите его формулу). Комплексные анионы для элементов в степени окисления 3+, малохарактерны и не имеют особенностей в названиях. Пентаиодиды неизвестны, но известен тетраиоддифосфин (о производных более легких аналогов йода, информация малодостоверна) P2I4 и такой же диарсин. Катодные осадки, получаемые при электролизе водных растворов трихлорида сурьмы, представляют собой твердые растворы трихлорида и металла, легко разлагающиеся и называемые взрывчатой сурьмой. По всей видимости, аналогичные вещества, составов типа BiCl образует и висмут. PF3 образует комплексы с d-металлами типа карбонилов – трифторфосфиновые, например тетракистрифторфосфин палладий Pd(PF3)4, но они менее характерны, чем карбонилы.
2.9. Подгруппа углерода. 2.9.1 Углерод. Из неорганических галогенидов известны только тетрагалогениды. Целый ряд соединений традиционно относят к классу органических (в т.ч. обширнейший класс фреонов) и мы их здесь рассматривать не будем. Кроме указанных веществ известны соединения, относящиеся к классу слоистых соединений графита (ССГ) примерного состава для хлора и брома C8Cl. Фторид графита имеет состав от C4F до CF. Анионные и катионные формы для углерода не получены. Вещества со степенью окисления +3 отвечают гексагалогенэтанам C2Hal6 (производное йода неизвестно), + 2 тетрагалогенэтиленам C2Hal4 (но не йод), +1 известны в виде дихлорацетилена и дибромацетилена C2Hal2. Из простых соединений содержащих водород наиболее известны галогеноформы – например. хлороформ CHCl3. Важную роль в качестве промежуточных частиц, получающихся из галогеноформов, играют свободные бирадикалы – галогенкарбены состава CHal2, например, дифторкарбен CF2 – промежуточный продукт разложения фреона-22 CHClF2. Номенклатура фреонов будет рассмотрена в другом разделе.
2.9.2 Кремний. Кремний образует тетрагалогениды и гексафторосиликаты – соли гексафторкремниевой кислоты H2SiF6, известной, как и все комплексные кислоты, только в растворе. Известны аналогичные карбенам силены SiHal2. Среди галогенсиланов были получены гексафтордисилан Si2F6 и SinHal2n+2, где n для хлора может достигать 25. Данная экзотика называется через латинские числительные.
2.9.3 Германий, олово, свинец. Вся группа элементов образует дигалогениды. Свинец (IV) образует производные йода только в виде анионного комплекса гексайодоплюмбата (IV) [PbI6]2-. Известны комплексные фториды всех элементов ЭF62-, а также K3HPbF8, явно содержащий анион HF2- как бидентантый лиганд, с мостиковым атомом водорода между фторид-ионами. Осаждением из водных растворов может быть получен плохорастворимый фторохлорид свинца PbClF. Этой реакцией можно пользоваться в целях аналитической химии.
2.10 Подгруппа бора. Все элементы образуют серию тригалогенидов. Бор образует также соли тетрафторборной кислоты HBF4 (известна только в водном растворе). Аддукты, т.е. продукты присоединения к аммиаку и другим соединениям, содержащим не поделенную электронную пару, самостоятельных названий не имеют. Примером неорганического аддукта является соединение с аммиаком H3N·BF3. Другой пример H2O·BF3. Это более сложное соединение, сильная кислота в растворе (аддукт с аммиаком – нейтральное вещество). В водном растворе аддукта трифторида, среда кислая за счет образования трифторогидроксоборат-аниона.
H2O·BF3 ↔ H+ + [B(OH)F3]-
Для алюминия характерен октаэдрический анион гексафторалюмината [AlF6]3-, соединения с меньшим числом атомов фтора - полимеры с общей вершиной [AlF5]2- или ребром октаэдра [AlF4]-. Известны также гексафторогаллаты и гексафториндаты. Другие производны комплексных анионов малохарактерны, можно лишь отметить своеобразные хлороталлаты и бромоталлаты (III) таллия (I) Tl[TlCl4], Tl3[TlCl6]. Существование трииодида таллия сомнительно, его структура неясна. Дигалогениды индия In2Hal4 – димерны, как и соответствующие анионы, например, гексахлородииндаты [In2Cl6]2-. Такой же хлорокомплекс известен для галлия. Бор образует молекулярные фторид и хлорид состава B2Hal4. Правильное их название соответствующие тетрагалогениды дибора. Для молекулярных B4Cl4 и т.п. можно использовать методику для дифторида дикислорода – тетрахлорид тетрабора. Моногалогениды алюминия AlHal известны только в газовой фазе и называются субгалогенидами. Термин суб всеобщий, он обозначает соединение в низшей, нехарактерной для элемента степени окисления.
2.11 Подгруппа бериллия. Для этих элементов характерных дигалогениды, но поскольку они фактически существуют в единственном числе, то числительное опускают. Комплексный анион один – тетрафторобериллат [BeF4]2-. Соединения типа NaMgF3 являются двойными солями, в них нет комплексного аниона. Такого рода соединения называют так: фторид магния-натрия. CaF2 – важный структурный тип флюорита. Кроме того, начиная с кальция известны субгалогениды MHal. Они получаются по реакциям
M + MHal2 (t) ↔ 2MHal
и при понижении температуры диспропорционируют на исходные вещества.
2.12 Подгруппа лития. Для всех элементов известны монофториды. В литературе можно встретить упоминания о KF2, RbF2/RbF3 и CsF3, но единственное что ясно, что дифторид калия не ионное соединение. К подобного рода сообщениям следует относиться с большой осторожностью, во всяком случае дифторид калия не может быть ионным соединением, как показывают расчеты. Из комплексных анионов сообщалось только о LiF43-, но это предположение основывалось на довольно зыбкой почве изоморфизма кристаллов, что вовсе не свидетельствует об изоструктурности внутреннего содержимого. Тем более в присутствии такого мощного акцептора фторид-ионов как Al3+ (вещество – минерал криолитионит Li3Na3Al2F12). Для хлора и брома особенностей нет, полииодиды мы обсудили ранее. NaCl и CsCl важные структурные типы.
2.13. Инертные газы. 2.13.1 Эксимеры. Известен целый ряд веществ, атомы в которых связаны между собой Ван-дер-Ваальсовыми взаимодействиями. Это эксимеры, примером которых может служить ArCl. Клатраты (газогидраты) мы рассмотрим в другом разделе.
2.13.2 Криптон. Достоверно известно существование дифторида криптона и солей монофторкриптония, например гексафторантимоната [KrF]+[SbF6]-. Существование тетрафторида сомнительно.
2.13.3 Ксенон. Известны ди, тетра и гексафториды, существование октофторида сомнительно. Существует класс соединений, важный с номенклатурной точки зрения, для примера возьмем XePtF6. Его структурная формула [Xe2F]+[Pt2F11]-. Это ундекафтородиплатинат (V) монофтордиксенония. Известны катионы [XeF3]+, [XeF5]+ и анионы [XeF7]-, [XeF8]2-, чьи названия не представляют собой трудностей. Ди- и тетра- хлориды и бромиды получены радиохимическими методами, хотя сообщалось и о том, что дихлорид может быть получен из элементов.
2.13.4 Радон. Спектр фторидов должен совпадать с таковым ксенона, но существование октофторида еще более сомнительно. Сообщалось о тетрахлориде, но и это малодостоверная информация. Проблема радона – его высочайшая радиоактивность, радиолиз его соединений и восстановление их продуктами распада.
2.14 d-металлы. 2.14.1 Подгруппа скандия. С номенклатурной точки зрения здесь нет каких-либо особенностей. Это тригалогениды, гексафтороскандаты. Соединения типа NaYF4 – двойные соли. Известны CsScCl3 и CsScBr3, получающиеся электрохимическими методами. По всей видимости, они также являются двойными солями.
2.14.2 Подгруппа титана.Для всех элементов известны все тетрагалогенидыи тригалогениды. Однако для трехвалентных циркония и гафния существование фторидов сомнительно. Неизвестны они и для двухвалентных состояний (о TiF2 сообщалось). Существование ZrCl, HfCl также сомнительно. Наиболее устойчивы комплексные ионы типа MF62-, не представляющие номенклатурного интереса.
2.14.3 Подгруппа ванадия.Ванадий образует полный набор ди- и тригалогенидов. Известны VF4, VCl4, VF5, VF6-. Тетрабромид известен только в газовой фазе, его синтез является одним из примеров транспортных реакций. Три-, тетра- и пентагалогениды, комплексные ионы (V) с фторид-ионами ниобия и тантала не имеют особенностей. Низшие галогениды – кластерные, обычно не имеют собственных названий. Они имеют составы типа Nb6Cl14 и Nb6F15 (такие «крокодилы» просто читают) В них содержатся кластерные катионы M6Hal86+/7+ в зависимости от состава. В литературе можно встретить недопустимые упрощения типа Nb3Cl7 но их следует избегать. Из комплексных анионов наиболее стабильны MF6-, а а также получены производные типа MF72- для ниобия и тантала.
2.14.4 Подгруппа хрома. Для хрома известны все фториды от CrF2 до CrF6, ди- и тригалогениды, а также Cr2F5. Тетрахлорид и тетрабромид известны в газовой фазе, образуются по транспортным реакциям в токе галогена. Дигалогениды молибдена и вольфрама имеют кластерную структуру с катионом типа [Mo6Cl8]4+. Для молибдена известны все тригалогениды, трифторид вольфрама не получен. Синтезированы все тетрагалогениды, у брома это потолок для молибдена, но пента- и гексабромиды вольфрама получены. Высшим иодидом обоих элементов является тетраиодид. Гексафториды присоединяются к фторидам щелочных металлов, с образованием комплексных анионов MF7- иMF7-.
2.14.5 Подгруппа марганца. Марганец образует ди-, три- и тетрафториды. Три и тетрахлорид резко неустойчивы, их любят давать сюрпризом на олимпиадах. Бром и йод дают только дигалогениды. Из комплексных анионов известны MnF63- и MnF62-. Из-за образования первого из них, титрование перманганатом в присутствии фторид-иона затруднено – высока ошибка измерений.
Технеций образует тетра, пента и гексафторид, тетра и пентахлорид. О производных тяжелых галогенов известно мало. Известны комплексны галогениды типа TcHal62-.
Низшие галогениды рения кластерного типа. Дигалогениды имеют состав типа Re6Hal12, трихлорид имеет состав Re3Cl9. Численность галогенидов с ростом атомного номера уменьшается от ReI4 к ReF7. Получены нонафторренаты ReF92-.
2.14.6 Восьмая группа. 2.14.6.1 Семейство железа.Для данного семейства получены все без исключения дигалогениды. Тригалогениды получены для железа (но не FeI3, существование Fe3I8 крайне сомнительно, хлорид димерен). У кобальта устойчив трифторид, остальные тригалогениды были получен в водном растворе на холоду (не выше -5 0С). Известны все комплексные фториды MF63- и MF62-. Существование NiF3 сомнительно.
2.14.6.2 Рутений и осмий.Из фторидов металлов получены от RuF3 до RuF6 и от OsF4 до OsF7. В старой литературе можно найти сообщение об октофториде осмия, но оно довольно сомнительно, исходя из методики синтеза гептафторида. Пентафториды, как и у других платиновых металлов тетрамерны. Известны серии остальных галогенидов ди и три, а также OsI, OsCl4 и OsCl5. RuCl4 существует только в газовой фазе Комплексные кислоты и их соли, начиная с хлора известны для составов MHal63- (фториды не характерны) и MHal62- для фтора и хлора (тоже для иридия и частично родия), а также MF6- - общий анион для всех платиновых металлов.
2.14.6.3 Родий и иридий. Фториды известны от три- до гекса-. Получены RhCl63-, разлагающийся водой с выделением хлора Cs2RhCl6. Известны все тригалогениды. Сообщалось о низших галогенидах, но они не характерны. Для иридия известны три- и тетрагалогениды и соответствующие комплексные кислоты и их соли..
2.14.6.4 Платина и палладий. Получен дифторид палладия. Трифторид палладия видимо представляет собой гексафторапалладат палладия, возможно, такой же образует платина, тетра, пента и гексафториды известны. Платина образует простые ди и тетрагалогениды, палладий только ди. Для не фторид иона получены комплексные анионы PdHal42-, для платины получены все PtHal62-, для палладия аналогичные ионы известны только для фтора и хлора.
Моногидрат трихлоро(этилен)платината (II) K[Pt(C2H4)Cl3]·H2O – соль Цейзе.
2.15 Подгруппа меди. Получены все моногалогениды, кроме монофторидов меди и золота. Все кроме монофторида серебра не растворимы, для золота и меди характерны хлор и бромкомплексные анионы MHal2-. Получены дигалогениды (кроме иодида) меди и AgF2, а также субфторид Ag2F. Медь и серебро образуют комплексные фториды MF63- MF62- с тяжелыми щелочными металлами типа рубидия и цезия. Золото образует трифторид, трихлорид и трибромид в смеси с монобромидом. Комплексные анионы соответствуют составу AuHal4-, для йода не получен. Пентафторид золота дает комплексный анион AuF6-, известен и AuF7.
2.16 Подгруппа цинка. Получены все диигалогениды. Комплексные анионы характерны для кадмия начиная с хлоридов, вплоть до CdCl64-. Из-за сильного комплексообразования растворы галогенидов кадмия обладают большой вязкостью и пониженной электропроводностью. Монохлориды кадмия и цинка могут быть стабилизированы в виде солей типа Cd2(AlCl4)2 при высоких температурах. Дихлорид ртути – сулема, дихлорид диртути – каломель. На восстановлении этого хлорида до металла основан каломельный электрод. Концентрированный раствор K2HgI4 – жидкость Туле, обладает большой плотностью и используется для минералогического анализа.
2.17 Лантаноиды. Все лантаноиды образуют тригалогениды. Существует ряд дигалогенидов, особенно характерных для европия, самария, тулия и иттербия. Из тетрагалогенидов получены тетрафториды Ce, Pr и Tb. Известны комплексные фториды типа Cs3MF7 M = Nd, Sm, Dy, Tm. Впрочем, за исключением «слегка сломанного языка» вам здесь ничего не грозит.
2.18 Актиноиды.Здесьвсе достаточно примитивно, за исключением того момента, что были описаны U4F17 – гептадекафторид тетраурана (аналогичное соединение было описано дла протактиния и U2F9.Единственный вопрос вызывает существование NpF7.Вещества типа CmF6 и BkF6 получают методом радиохимического синтеза. Пентафториды, начиная с нептуния склонны к диспропорционированию и не характерны.
Дата добавления: 2021-09-07; просмотров: 1209;











