Производные пниктогенов.
5.1. Общие замечания. Пниктогенами называют элементы подгруппы азота, но это не устоявшийся термин. Соответствующими пниктогенидами – их соединения в отрицательной степени окисления. Как этого и следовало ожидать, наибольший номенклатурный интерес представляю собой производные азота, с которых мы и начинаем каждый раздел. Внутри это раздела даются краткие замечания по производным более тяжелых аналогов.
5.2 Нитриды водорода. Собственно нитридом водорода является аммиак NH3, записываемый против формальных правил, когда электроположительный элемент должен быть левее электроотрицательного, т.е. верная запись H3N, но ее применяют всегда в тех случаях, когда важно подчеркнуть то, что аммиак отдает свою электронную пару как донор, ее акцептору. В частности, помимо общеизвестного и ниже обсуждаемого процесса образования солей аммония и имеется процесс образования аддуктов. В химической реакции вида
NH3 + HCl → NH4Cl
получается хлорид аммония с катионом состава [NH4]+. Квадратные скобки в данном случае обычно опускают, например сульфат аммония записывается как (NH4)2SO4, хлорид NH4Cl.
Раствор аммиака в воде называют аммиачной водой, в котором имеет место последовательная серия реакций
NH3 + H2O ↔ NH4OH ↔ NH4+ + OH-
Гидроксид аммония NH4OH известен только в растворе.
При реакции вида
NH3 + BF3 = H3N:BF3
получается аддукт (продукт присоединения), который так и называют – продукт присоединения трифторида бора (кислота, в данном случае в смысле Льюиса выступает как активный агент) к аммиаку (аммиак, как основание в смысле Льюиса – пассивный агент, хотя термины пассивный и активный следует рассматривать в общефилософском смысле). В приведенной выше записи, мы использовали (:) для того чтобы подчеркнуть – передается электронная пара, но обычно аддукты (как и кристаллогидраты солей) обозначают через точку (·).
Продукт замещения одного атома водорода в аммиаке называется амидом (дигидронитридом, термин не общепринят), например калия KNH2, двух – имидом (гидронитридом, термине не общепринят) К2NH. Получен и нестойки нитрамид H2NNO2, известна и его средняя соль ртути HgNNO2 – нитритоимид (диоксонитратонитрид) ртути. Амиды и имиды органических кислот характерный класс соединений, из неорганических можно назвать разве лишь диамид угольной кислоты – мочевину (NH2)2CO. Аналогичные, но более сложные соединения мы рассмотрим в подразделе производных углерода.
Пернитридом водорода первого типа (термин не принят, означает степень окисления азота -2) может быть назван гидразин N2H4 – динитрид тетраводорода. Активные металлы, например калий, могут замещать один из атомов водорода с образованием гидразидов – тригидродинитридов KN2H3.
Динитрид диводорода (пернитрид второго типа, термин не принят) – диимид, N2H2, крайне неустойчив. Он хорошо известен в форме органических производных, например («А-номенклатура») 2,3-диазабутена-2 CH3-N=N-CH3 – симм-диметилдиимида.
Азидоводород – динитридонитрат (V) водорода HN3, типичный представитель псевдогалогенидных производных. Так их называют за сходство с галогенид-ионами. Другие представители этого класса будут рассмотрены в рамках номенклатуры производных углерода. Азид свинца (II) Pb(N3)2 используется в капсюлях патронов как инициатор возгорания пороха.
Производные подгруппы фосфора носят следующие названия фосфин PH3, дифосфин P2H4, арсин AsH3, диарсин As2H4, стибин SbH3 и висмутин BiH3. Гидроксид фосфония PH4OH основных свойств не проявляет и является скорее гидратом фосфина. Соли фоcфония PH4+ представляют собой неустойчивые вещества, при малейшем нагреве разлагающиеся на исходные реагенты, и очень чувствительные к окислительным «манерам» аниона. Наиболее устойчив иодид PH4I. Из солей арсония получен только иодид в смеси жидких исходных веществ. Он настолько неустойчив, что существование катиона AsH4+ удалось доказать только методами спектроскопии.
5.3 Подгруппа серы. Нитриды этих элементов представляют собой структурный интерес у серы, но не у ее аналогов. Простейший из них продукт замещения одного из атомов серы в кольце S8 на группу NH - S7NH.
Производные фосфора и его аналогов – сульфиды, селениды и теллуриды. Многие из них – минералы.
5.4 Подгруппа фосфора. Фосфор образует нитрид (V) P3N5 и полимерные динитридофосфаты типа LiPN2. Сообщалось о нитриде мышьяка, полученном по реакции
AsF3 + 4NH3 = AsN + 3NH4F
Класс нитридогалогенидов сравнительно узок, например фосфонитрилхлорид PNCl2 известный в виде полимеров – циклического тримера или линейного полимера. Еще менее характерны для азота оксонитриды, как правило не полученные в чистом виде, а обычно в виде смесей фаз на поверхности d-металлов.
5.5 Подгруппа углерода. 5.5.1 Углерод.Из нормальных нитридов известен Si3N4. Нитриды более тяжелых аналогов не получены. Основным производным углерода является дициан (CN)2 (нитрид известен, но получается из производных этого типа). Он лежит в основе целого класса соединений - псевдогалогенидов. Термическим его разложением получают циан CN, известный лишь при высоких температурах, например на поверхности относительно холодных звезд, таких как Солнце.
При разрыве связи C-C с заменой их на C-H образуется циановодород HCN. Его водный раствор – сильнейший яд, называемый цианистоводородной или синильной кислотой. Ее соли – цианиды, обычно также крайне токсичны, например цианид калия KCN (на химическом сленге – калий циничный). Цианид-ион хороший комплексообразователь, известны многочисленные комплексные анионы и соли. С номенклатурной точки зрения важны красная кровяная соль – гексацианоферрат (III) калия K3Fe(CN)6 и желтая кровяная соль K4Fe(CN)6. Первая реагирует с солями железа (II) с образованием турнбуллевой сини, вторая – с солями железа (III) с образованием берлинской лазури. На деле это изоструктурные соединения с валовым составом KFeFe(CN)6 – гексацианоферраты (III) калия – железа (II). Цианиды известны в очень широкой области степеней окисления. В низших степенях окисления, будучи изоэлектронной угарному газу цианидная группа образует многочисленные комплексы карбонильного типа. Известны и высшие соединения, вплоть до октоцианогидроксорената (VII) калия K2[Re(CN)8OH].
В органической химии группа CN называется нитрильной (нитрилом). Известен значительно менее характерный изонитрил –N=C:, в этой форме при обычных условиях содержится всего 0,5% молекул HCN (при нагревании таутомерное равновесие в циановодороде смещается в ее сторону). Из полимеров синильной кислоты выделен циклический тример (симм-триазин, 1,3,5-триазабензол) и тетрамер – 2,3-дициано-1,4-диазабутен-2. Гексациан - 2,4,6-тринитрило-1,3,5-триазабензол.
Изонитрилы характерны для органических производных. Заменой водорода в циановодороде на группу NH2 получается цианамид H2NCN. Его тример – меламин 1,3,5-триамино-2,4,6-триазабензол. Цианамид кальция CaNCN ранее использовался как азотное удобрение, при его водном гидролизе образуется кислая соль - гидроцианамид. Дифторцианамид F2NCN в присутствии фторида цезия изомеризуется в дифтодиазирин – 1,1-дифтор-2,3-диазациклопропeн-2.
Цианамид имеет изомер – диазометан CH2N2 линейного строения, представитель обширного класса органических диазосоединений, наиболее устойчивыми из которых являются ароматические соли диазония ArN2+ (не путать символ Ar – ароматический, с аргоном).
Третьим представителем этой «теплой компании» является диазирин – 2,3-диазациклопропен-2.
Цианамид реагирует с аммиаком с образованием имидомочевиды, гуанидина – диамидоимида углерода
NH3 + H2NCN → (H2N)2CNH
Получается азотистый аналог мочевины, обладающий заметно основными свойствами. При протонировании образуется плоский катион триаминокарбония [C(NH2)3]+. Нитрат этого катиона взрывчат. Известны и соли гуанидина в качестве кислоты, в которых замещены один или два атома водорода в амидогруппах (по всей видимости, разных). Осадки серебряных солей получают обработкой нитратом серебра щелочных растворов гуанидина.
Известны галогенцианы HalCN. Помимо фторциана получен 1,1,2,2-тетрафтор-3,4-диазациклобутен-3. Тримеры галогенцианов - галогенциануры 2,4,6-тригалогениды-1,3,5-триазабензола. Из смещанных соединений известны дифторхлор и дихлорфтор производные. Крайним случаем соединений типа псевдо-галогенид-псевдо-галогенид является цианазид N3CN. Его тримеризация дает циануразид – 1,3,5-триазидо-2,4,6-триазабензол. Предельный случай азидов углерода – гексахлороантимонат триазидокарбония [C(N3)3]+[SbCl6]-.
Дицианимид (биснитридокарбонатимид водорода) водорода HN(CN)2 известен, это кислота, которая может быть получена только в растворе по серии реакций
Na2NCN + BrCN → NaBr + NaN(CN)2
CuCl2 + 2NaN(CN)2 → Cu(N(CN)2)2 + 2NaCl
Cu(N(CN)2)2 + H2S → CuS↓ + 2NH(CN)2
При попытке ее выделения она полимеризуется в продукт известный на химическом сленге как «каша» - нечто непонятной консистенции, или «забор» – типичный вид спектра или дифрактограммы, из которого можно выудить лишь некоторые предположения о структуре или составе.
Известны и цианиды неметаллических элементов дицианиды серы, теллура, трицианиды фосфора и мышьяка, тетрацианид дифосфора P2(CN)4, карбонилцианид (динитрил 2-оксопропандиовой кислоты) CO(CN)2, тионилцианид SO(CN)2.
Как мы видим, между водородом и углеродом возможна вставка другой группы. Какие еще неорганические производные можно получить такими вставками? Рассмотрим реакцию, аналогичную диспрорционированию галогенов
2NaOH + (CN)2 → NaCN + NaOCN
Получающиеся оксоцианаты соли циановой кислоты. Она существует в виде двух таутомерных форм. Сама циановая кислота – оксоцианид (оксонитридокарбонат) водорода HOCN, изоциановая – HNCO, имидокарбонат (нитридооксокарбонат). Имидоформа превалирует в равновесной смеси таутомеров, при охлаждении доля оксоформы растет. Органические производные известны только для изоциановой кислоты, цианатные комплексы металлов – оксоцианаты. Концентрированные растворы циановой кислоты полимеризуются в циануровую кислоту (HOCN)3 – 1,3,5-тригидрокси-2,4,6-триазабензол.
Цианаты известны для следующих неметаллов. Для фосфора трицианаты фосфора и тетрацианаты дифосфора, монофтор/хлордицианаты, дифтор/дихлорцианаты. Известны оксо и тиотрицианаты фосфора, например PS(NCO)3, цианат сульфурила, пентоксодицианат дисеры S2O5(NCO)2. Галогенцианаты склонны к димеризации с образованием 1,1-дигалоген-2-оксо-1,3-диаза-5-оксапентана Hal2NC(O)NCO.
Еще одна структурный изомер – гремучая кислота (оксонитридокарбид водорода) HCNO, ее соли фульминаты. Фульминат ртути (II) – гремучая ртуть.
По реакции в четыреххлористом углероде
2AgNCO + I2 → 2AgI + (NCO)2
был получен оксоциан (1,6-диокса-3,4-диазагексатетраен-1,2,4,5). Он неустойчив. Еще больший химический раритет фтороксоциан FNCO (фторонитридоксид углерода).
Помимо кислорода к цианогруппе возможно присоединение серы с образованием тиоцианатов (имидотиокарбонатов) S=C=N- – роданидов. По структуре роданидов имеются вопросы – вполне возможно, что это сульфидоцианиды –S-C≡N
2NH3 + CS2 + Ca(OH)2 → CaS↓ + NH4SCN + 2H2O
Роданид аммония – типичный реагент в аналитической химии, в частности по характерному окрашиванию в красный цвет, выявляют наличие в растворе солей кобальта. Сама кислота разбавленной серной кислотой переводится в тиоокиcь (оксосульфид) углерода COS. Раствор брома, в сероуглероде действуя на роданид серебра, образует свободный родан (SCN)2 – 1,6-диаза-3,4-сульфагексадиин-1,5. Его получение свидетельствует в пользу сульфидоцианидной структуры. Думается, что на самом деле роданиды имеют структуру, не описываемую в рамках классической теории валентности и для ее описания нужен метод МО ЛКАО.
Получены были и циансульфаны Sn(CN)2, где n = 1 – 6. Из аналогичных производных селена, известен дицианиды селена, диселена и триселена, роданид селена (II). Сам селеноимид углерода получен только в водном растворе HNCSe, его калиевая соль имидоселенокарбонат в воде хорошо растворима, серебряная плохо. Т.о. селеноимиды также относятся к классу псевдогалогенидов. У селеноцианатов как еще называют эти соли, связь аниона с металлом осуществляется через селен – как у платины и палладия, или же через азот – как у железа и никеля.
Родан может быть прохлорирован с образованием нитридохлоросульфида углерода ClSCN и хлорсульфидоимидохлоридахлорида углерода (3-хлор-1,5-дихлора-2-сульфа-4-азапентена-3) ClSCCl=NCl. Его фосфорные производные – трироданид, а также оксо и тиотрироданиды. Известны дигалогенроданиды (F и Cl), оксодихлорроданиды. Нитридодироданиды фосфора известны – это тример и тетрамер, склонные к образованию полимера. Трироданид мышьяка нестоек.
Родановая ртуть (роданид ртути (II)) при нагревании разлагается с выделением объемистого нитрида углерода C3N4. Эта реакция сопровождается выбросом нитрида в виде желтой пористой змееподобной массы (фараонова змея). Удобнее его получать разложением цианида серы на сероуглерод и нитрид.
Наконец последний представитель этого обширнейшего класса веществ – рубеановый водород
2HCN + 2H2S → (H2NCS)2 + H2
Он существует в двух таутомерных формах – диамида тиощавелевой кислоты (2,3-дисульфидо-1,4-азабутана) и диимидодигидросульфида HN=CSH-CSH=NH (1,4-диазабутадиен-1,3-дитиол-2,3). Тривиального названия у солей рубеанового водорода нет.
Цианиды и многочисленные их производные, не исчерпывают всего набора псевдогалогенидов. К этому же номенклатурному классу относят азиды.
Биурет (диамид аллофановой кислоты, 2,4-диоксо-1,3,5-триазапентан) (NH2CO)2NH и триурет (целый список названий – 1,3-дикарбамил мочевина, к примеру, но 2,4,6-триоксо-1,3,5,7-тетразагептан) (NH2CONH)2CO. Триурет состоит из двух шестичленных колец, внутренние смыкающие ребра которых образованы водородными связями.
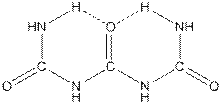
Карбид водородафосфора HCP известен, но нестоек и склонен к полимеризации. Обработкой хлороводородом превращается в метилдихлорфосфин CH3PCl2.
Сообщалось о получении ацетиленида фосфора P2(С2)3.
5.5.2 Подгруппа кремния. Известны нитрид кремния Si3N4, производные полимерного динитридосиликат-иона SiN22-. Фосфид и соответствующий арсенид имеют составы SiЭ2. Из тяжелых аналогов известны азиды, важнейшим из которых является азид свинца (II).
5.6 Подгруппа бора. Элементы этой подгруппы образуют соединения типа AIIIBV, устойчивость которых падает с ростом атомного номера, а их названия за исключением нитридов бора не представляют собой номенклатурного интереса. Нитрид бора существует в двух кристаллических модификациях. Первая, графитоподобная, состоит из плоских шестиугольных колец и называется белым графитом. Связи между атомными плоскостями в нем слабые и он легко раскалывается вдоль плоскостей.
В алмазоподобной модификации (боразон или эльбор – ленинградский бор), атомы бора и азота находятся в тетраэдрическом окружении, четвертая связь возникает за счет электронной пары азота и свободной p-орбитали атома бора. В белом графите соответствующие орбитали взаимодействуют между собой между плоскостями.
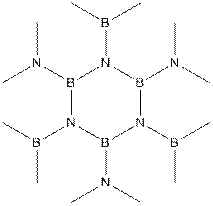
Известно и вещество, которое принято называть неорганическим бензолом – боразол – циклический (BHNH)3. В А-номенклатуре мы можем назвать его 1,3,5-триаза-2,4,6-триборабензол, но им не пользуются.
Фосфиды, арсениды и антимониды галлия и индия состава AB – важные полупроводниковые материалы.
5.7 Подгруппа бериллия. Соединения этой подгруппы характеризуются валовым составом M3A2. Амиды и имиды для них малохарактерны. Сообщалось и о пернитриде бария BaN2.
5.8 Подгруппа лития. Щелочные металлы растворяются в жидком аммиаке, образуя синие растворы, содержащие сольватированный электрон. Постепенно они разлагаются с образованием соответствующих амидов. Подобного рода свежеприготовленные растворы используют как сильнейший восстановитель в органическом синтезе. Сами амиды щелочных металлов (на практике – натрия, из-за его дешевизны), используются как сильнейшие основания в этой же области применения. Нитриды нестойки, легче всего получается нитрид лития (уже при комнатной температуре из элементов) Li3N. Состав фосфидов и их более тяжелых аналогов сложнее и не отвечает классической валентности.
5.9 d-металлы. Более или менее простые пниктогениды – нитриды подгруппы скандия типа ScN. Такие же структуры характерны для подгруппы титана. С подгруппы ванадия начинаются нестехиометрические вариации. Начиная с хрома, формулы становится нетривиальными. По технецию и рению имеется ряд вопросов о существовании соответствующих нитридов. Для платиновых металлов они неизвестны. Единственное производное нитридоподобного типа триоксонитридоосматы (VIII) KOsO3N. Нитриды группы железа обычно отвечают составам типа M3N, составы со стехиометрическими коэффициентами по металлу 2 или 4 малостойки, или не получены. Нитриды меди и группы цинка отвечают составам M3N2. Нитрид серебра Ag3N осаждается из насыщенного аммиаком раствора фторида. Нитрид золота не получен.
С ростом атомного номера пниктогенов, доля металлической связи в соответствующем соединении растет. Фосфиды довольно разнообразны по составу, большинство арсенидов, антимонидов и висмутидов характеризуются формулами М3Э, М3Э2, МЭ и МЭ2.
Специфический класс производных типа карбонилов образуют трифенилфосфин (С6H5)3P и трифторид фосфора, например тетракистрифторфосфин палладий Pd(PF3)4.
5.10 f-металлы. Никаких особенных изысков здесь нет. Большинство составов отвечают формулам типа MЭ и MЭ2.
Дата добавления: 2021-09-07; просмотров: 1087;











