Производные кислорода.
3.1 Введение. Среди производных кислорода можно выделить несколько классов соединений. Это соединения с положительной степенью окисления (фториды OnF2, вещества с фтороксигенильной группой OF – фторонитрат NO3F, метфорилфторид CF3OF (об этой фор-номенклатуре в соответствующем разделе), фторидные соли катиона оксогенила O2+, (к примеру, гекасфтороплатинат (V) оксогенила O2PtF6). Второй, и также сравнительно небольшой класс веществ, это перекисные соединения, содержащие пероксид-ион O22-, ковалентную пероксогруппу -O-O-, надпероксид-ион O2- и озонид-ион O3- (озониды органических веществ рассматриваются кратко). Все они будут рассмотрены далее, в рамках вопросов химии отдельных элементов, к которым мы и приступаем.
3.2 Оксиды. Бинарные соединения кислорода, содержащие только ион O2- или изолированные атомы концевого =O и/или мостикового -O- кислорода (мы говорим здесь о примитивной структуре оксидов, в их «первобытно-химическом смысле», не отвлекаясь на реальные кристаллические решетки) называют оксидами. Для названия стехиометрических оксидов удобно пользоваться таблицей соответствий (табл. 2).
Таблица 2
| Формула | Пример | Русскоязычное название | Международное название |
| R2O | Rb2O | Полуокись, полуокисный элемент, например, полуокисный рубидий | Гемиоксид рубидия |
| RO | CaO | Окись кальция, окисный кальций | Монооксид кальция |
| R2O3 | La2O3 | Полуторная окись лантана, полутораокисный лантан | Сесквиоксид лантана |
| RO2 | ZrO2 | Двуокись циркония, двуокисный цирконий | Диоксид циркония |
| R2O5 | Ta2O5 | Пятиокись тантала | Пентаоксид тантала |
| RO3 | WO3 | Трехокись вольфрама | Триоксид вольфрама |
| R2O7 | Re2O7 | Семиокись рения | Гептаоксид рения |
| RO4 | OsO4 | Четырехокись осмия | Тетраоксид осмия |
Как и в случае галогенидов, если оксид единственный, то числительные опускают. В приведенной таблице так можно поступить с рубидием, кальцием и лантаном. Несмотря на то, что приготовить ZrO затруднительно, ZrO2 в широкой практике называют не оксидом, а диоксидом циркония. Заметим также, что необходимости введения полуокиси и полуторной окиси обусловлена существованием монооксидов и триоксидов (для галогенидов подобная путаница невозможна).
Сохраняется и стандартизированный вариант с римским числительным, например оксид железа (III) Fe2O3. Оксид железа (II, III) Fe3O4 называют закисью-окисью железа (см. далее), или тетраоксидом трижелеза. Аналогично можно поступать с Pb3O4 (но учитывая, что это оксид (II, IV)), но не с AgO, Ag3O4. AgO – это оксид серебра (I, III) Ag2O2 (в старой литературе фигурирует как пероксид), Ag3O4 оксид серебра (II, III), зачастую выделяющийся в виде анодного осадка в комплексе с монофторидом (Ag4FO4) или нитратом серебра (Ag4NO7). Уран, помимо того, что мы можем назвать закисью UO2 и окисью UO3, образует U2O5, который является истинным оксидом (V), а не смешанновалентным оксидом, как урановая смолка (геологическое название) – октаоксид триурана U3O8 (оксид урана (IV, VI)).
Замечание 1.При записи смешанновалентных оксидов и других подобных соединений, степени окисления в скобках пишут в порядке их возрастания.
Замечание 2. Мы уже говорили о закисях и окисях, настало время познакомиться с этой системой повнимательнее. Итак, если элемент образует два оксида, то в русскоязычной номенклатуре мы имеем два названия – соединение в низшей степени окисления называют закисью – PbO – закись свинца, в высшей окисью PbO2, смешанновалентный случай Pb3O4 – закись-окись. Ситуации, когда имеется целая серия смешанновалентных оксидов (причем пары степеней окисления идентичны, но доля катионов различна), довольно редка. Это соединения типа фаз Магнелли и веществ с плоскостями кристаллографического сдвига.
Оксиды традиционно делят на кислотные, основные, амфотерные и нейтральные, но с этой классификацией следует быть очень осторожным. Аналогично соотношения между гидратами окислов и самими оксидами, зачастую нетривиальны. Также некоторые оксиды называют «земли».
3.3 Производные водорода.Для того, чтобы наше изложение носило более связный характер, следует обратиться к соединениям между кислородом и водородом. Простейшее соединение из них – вода, оксид водорода H2O. Вообще говоря, сильные водородные связи объединяют молекулы воды в структурные группы до 4-х единиц, которые называют гидролями. Однако на практике, этими структурными единицами пренебрегают, это нужно тем, кто очень сильно углубляется в теорию, например, аномальной электропроводности водных растворов кислот и оснований.
Вода аутоиноизующийся растворитель
2H2O ↔ H3O+ + OH-
Катион H3O+ называется гидроксонием, анион OH- - гидроксид-ионом (в случае реализации ковалентной связи группа O-H, называется гидроксогруппой). Катион гидроксония – простейшая форма, которая осложняется структурой гидролей. Гидроксид-ион несомненно гидратирован, но координационные числа анионов в растворах исследованы плохо и мы не будем далее углубляться в эту тему. Соответственно те вещества, которые увеличивают долю ионов гидроксония (равновесная концентрация 10-7 моль/л) являются кислотами, гидроксид-ионов – основаниями. Дадим теперь определения кислот и оснований более подробно, нежели мы это обсуждали в теме галогенидов.
По Аррениусу кислотой называется всякое вещество, которое при электролитической диссоциации увеличивает долю протонов (таков жаргонизм, вместо ионов гидроксония) в водном растворе, основания – долю гидроксид-ионов. По Бренстеду-Лоури кислота донор протонов, основание акцептор. По Льюису кислота акцептор электронной пары (в системе того, что называют классическими кислотами, роль кислоты выполняет протон H+), основание – донор электронной пары (вода). В этом смысле вода играет роль основания в растворах кислот. Концепция Льюиса успешно описывает большинство случаев, но в системах высокотемпературных реакций, особенно в силикатных системах или же в механохимических процессах, требуется несколько иная концепция. Она была введена Луксом и Флудом и определяет основание как донор оксид-ионов O2-, а кислоту как его акцептор. Здесь, однако, следует быть очень аккуратным с понятийным аппаратом. Традиционная схема кислота + основание = соль, здесь может приводить к продукту ни в коей мере не описываемому в рамках классической теории. Например, реакция
La2O3 + γ-Al2O3 → 2LaAlO3
в планетарной мельнице АГО-2, протекает количественно в течении порядка 5-и минут (ускорение мелющих тел 40g, вес шаров 200 г, загрузка реагентов порядка 5 г). Получающийся алюминат лантана обладает структурой перовскита CaTiO3, в котором можно выделить подрешетку кислорода в тетраэдрических и октаэдрических пустотах которой, расположены катионы металлов. Другого описания эта структура не допускает, полученный продукт двойной оксид, но воленс-ноленс, мы, следуя традиции, называем это вещество алюминатом лантана.
Известны два радикала, образуемые водородом и кислородом. Гидроксильный радикал OH известен в космосе, где низкая концентрация частиц не позволяет им рекомбинировать между собой. Гидропероксидный радикал HO2 важный участник биохимических процессов, а также промежуточная частица при горении водорода и углеводородов (бензин, мазут и т.п.), наряду с гидроксилом, в кислороде. Рекомбинация этих радикалов между собой приводит к пероксиду водорода, а также три- и тетраоксиду водорода H2O3 и H2O4. Для выделения последних двух продуктов необходимо резкое охлаждение (закалка) реакционной смеси. Изотопные модификации воды D2O и T2O называются тяжелой и сверхтяжелой водой.
3.4.А. Гидраты окислов. Если гидратированные галогениды следует рассматривать как гидраты солей, обусловленные существованием гидратных оболочек катионов (об этом мы еще поговорим в последствии), то в гидратах окислов имеется ковалентная группа O-H, реже соответствующий гидроксид-ион OH-. Многие гидраты окислов отвечают формулам типа HxMyOz, где числа x и z необязательно равны. Особенно это характерно для кислот. Перейдем теперь к конкретике, начав с системы кислот галогенов и перемещаясь по таблице Менделеева к щелочам (гидраты оксидов щелочных металлов). Завершим обзор ксеноном и понятие клатратов, но для начала введем еще одно понятие.
3.4.Б Оксогалогениды. Вообще говоря, существует целый класс важных с практической и номенклатурной точки зрения оксогалогенидов и оксогалогеновых кислот. Их можно рассматривать как продукты замещения одной или нескольких гидроксогрупп, в соответствующем соединении. Мы будем рассматривать их детально в практически важных случаях, здесь же ограничимся только общими замечаниями. Пусть задан произвольный оксогалогенид MxOyHalz. Для того чтобы его назвать необходимо использовать следующую формулу:
число атомов кислорода + оксо + число атомов галогена + галогенид + элемент в родительном падеже
Например, диоксодихлорид серы SO2Cl2. При необходимости вводится числительное атомов элемента. Для галоген-кислородсодержащих кислот применяется методика числительное (моно в случае нескольких кислот не опускается) + число атомов кислорода + оксо + элементат водорода. Например, фторсульфоновая кислота HSO3F – фтортриоксосульфат (VI) водорода.
3.5.1. Кислоты и оксиды галогенов. Хлор образует 4 кислородные кислоты состава HClOn n = 1, 2, 3, 4. HClO – хлорноватистая кислота, HClO2 – хлорноватая, HClO3 – хлористая, HClO4 – хлорная. Соответствующие соли, в которых атом водорода замещен на металл, имеют такие названия: гипохлориты (оксохлораты (I)), гипохлораты (диоксохлораты, оксохлораты (III), хлораты (триоксохлораты, оксохлораты (V)), перхлораты (тетраоксохлораты, оксохлораты (VII)). Этим кислотам соответствуют (здесь и далее, как мы увидим, не всякой кислоте соответствует оксид, но даже и оксид! – см. кислоты серы и азота) кислотный оксид, который мы называем ангидридом. Таких ангидридов известно два – хлорноватистый Cl2O и хлорный Cl2O7. Вещества состава Cl-Cl=O, Cl2O3 полученные методами криохимии никак с соответствующими кислотами не связаны. Первое вообще не оксид (оксохлорид хлора), второе разлагается до того, как оно может вступить в реакцию с водой. Хлор образует диоксид (ClO2, димеризуется при охлаждении в тетраоксид дихлора) и триоксид (Cl2O6, в мономер превращается при нагревании). Cl2O5 не существует. Такие вещества, которые при гидролизе (реакции с водой, общий термин сольволиз) дают две кислоты, а при реакции с основаниями – две соли, называют смешанными ангидридами соответствующих кислот.
Смешанная соль хлорноватистой и соляной кислот Ca(ClO)Cl (хлорид гипохлорит кальция), называется хлорной известью (хлоркой).
Названия кислот брома тождественно кислотам хлора, но существование HBrO2 и ее солей вызывает вопросы. У йода существование аналогичной кислоты также под знаком вопроса, для астата она точно неизвестна, как вероятно, не синтезирована и кислота для степени окисления +7 (кислоты и анионы для +1 и +5 известны и не представляют номенклатурного интереса). Оставив радиоактивный астат в стороне, заметим, что оксиды брома из-за термической неустойчивости генетически с кислотами не связаны и называть их ангидридами хоть и можно, но не корректно в химическом смысле. Известны полученные методами криохимии Br2O, Br2O3, BrO2, BrO3. В старой литературе можно найти формулу Br3O8, по всей видимости, отвечающую смеси оксидов. Для йода получен йодистый ангидрид I2O5, триоксойодат (V) йода (III) – I(IO3)3. Сообщалось о существовании I2O·4Py (Py - пиридин), I2O4 и I2O7, но информация по двум последним оксидам выглядит неубедительной. Кислота йода +7 известна в трех формах. Метайодная HIO4 и мезойодная H3IO5 кислоты малоустойчивы, их соли – химический раритет. Куда важнее для практических целей ортойодная кислота H5IO6 (гексаоксойодат (VII) водорода). Вообще говоря, не каждый атом водорода в ней может заместиться на металл, по причинам гидролиза соответствующего аниона в водном растворе. Простые ортойодаты, например бария Ba5(IO6)2 хорошо известны, но нерастворимы. Растворимые же соли щелочных металлов существенно гидролизуются в воде по причине слабости кислоты по 4-й и тем более 5-й ступени диссоциации. В частности из растворов можно выделить, к примеру, две соли одна состава KH4IO6, другая K2H3IO6 (отвечает конечному результату титрования кислоты щелочью в водном растворе). Первая называется тетрагидрогексаоксойодат (VII) калия, вторую вы легко назовете сами. Общий принцип названия кислых и основных солей мы приведем в конце данного параграфа, хотя. проанализировав данный текст, вы сможете сформулировать его самостоятельно.
3.5.2 Кислоты серы. Мы рассмотрим здесь только кислородные производные серы, вопросы сульфидов, тиокислот и сульфанов отнесем к другому разделу. Серный ангидрид SO3 реагирует с водой образованием тетраоксосульфата (VI) водорода – серной кислоты. Однако, процесс на этом не останавливается. Если мы будем его поглощать просто водой, то образуется устойчивый сернокислотный туман – важный химико-технологический термин, описывающий не просто неважную, а довольно отвратительную ситуацию. Вообще говоря, в промышленном производстве серной кислоты идет поглощение триоксида серной кислотой с образованием олеума – смеси полисерных кислот с общей формулой H2SnO3n+1. Простейшая из них дисерная (гептаоксодисульфат водорода (VI)), H2S2O7 образует только один ряд солей пиросульфатов или дисульфатов (кислые соли неизвестны). В воде сами кислоты и их соли превращается в гидроксотриоксосульфаты (VI), гидросульфаты (соли трисерной и более высоких гомологов дают в растворе еще и свободную серную кислоту)
K2S2O7 + H2O → 2KHSO4
или как их еще называют, бисульфаты (термическое разложение их приводит к пиросульфатам). Тут важно не запутаться в названиях. При электролизе растворов бисульфатов, получаются соли пероксодисерной кислоты (гексаоксопероксодисульфаты (VI)
2KHSO4 (±) → H2↑ + K2S2O8
Последние постепенно гидролизуются с образованием солей пероксомоносерной кислоты (кислоты Каро) гидропероксотриоксосульфатов (VI).
K2S2O8 + H2O → KHSO4 + K(HOO)SO3
Перокосогруппа HOO диссоциирует крайне слабо и средние соли, триоксопероксосульфаты (VI), для кислоты Каро не характерны.
Растворимые соли серной кислоты (сульфаты, тетраоксосульфаты (VI)) обычно выделяются в виде кристаллогидратов. Это купоросы – медный CuSO4·5H2O (пентагидрат сульфата меди, степень окисления можно не указывать, поскольку Cu2SO4 количественно разлагается водой по реакции диспропорционирования), железный FeSO4·7H2O (гептагидрат сульфата железа (II), сульфат железа (III) известен, в т.ч. гидратированный). Сульфат кальция известен как безводный, так и в виде гемигидрата (гипс), дигидрата. Двойные соли вида M1+1M23+(SO4)2·12H2O называются квасцами, например алюмокалиевые (M1 = K, M2 = Al). Гексагидрат сульфата железа (II) - аммония, гидратированный двойной сульфат железа (II) – аммония, соль Мора (NH4)2Fe(SO4)2·6H2O, декагидрат сульфат натрия Na2SO4·10H2O – глауберова (удивительная) соль (мирабилит). Комплексные кислоты с лигандом в виде сульфат-иона малохарактерны. Примером такой кислоты может служить трис(тетраоксосульфат (VI)) цирконат водорода H2[Zr(SO4)3].
Сернистый газ (сернистый ангидрид) SO2 реагирует с водой с образование нестойкой сернистой кислоты H2SO3 (из раствора при охлаждении выделяется вещество клатратного типа SO2·7H2O) для которой были получены два ряда солей средние триокосульфаты (IV) к примеру, калия сульфит, K2SO3 и кислые, бисульфиты (гидроксодиоксосульфаты (IV)) KHSO3. Из последней соли, нагреванием, можно получить пиросульфит K2S2O5 (пентаоксодисульфат (IV) калия).
При пропускании сернистого газа через взвесь диоксида марганца в воде получают соли дитионовой кислоты – дитионат (гексаоксодисульфат (V)) марганца, из которого по обменным реакциям можно получить другие соли (кислота известна только в растворе).
MnO2 + 2SO2 → MnS2O6
Дитионовая кислота первый представитель ряда политионовых кислот H2SxO6. Легче всего из них получить тетратионаты, для чего используется реакция. получившая широкое распространение в лабораторной практике
2Na2S2O3 + I2 → Na2S4O6 + 2NaI
Используемая для этого соль тиосульфат натрия в виде пентагидрата (пентагидрат триоксосульфидосульфата (VI) натрия Na2S2O3·5H2O), широко применялась в химической фотографии под названием гипосульфита. Гипосульфитами на деле являются соли не полученной в свободном виде тетраоксодисерной кислоты, соли который получают из тетраоксодисульфата (III) цинка
Zn + 2SO2 → ZnS2O4
Вещество состава S2O представляет собой оксосульфид серы S=S=O.
Известны смешанные соединения, содержащие серу, кислород и галогены. Важнейшие из них фтористый и хлористый сульфурилы SO2Hal2, хлористый тионил SOCl2. Производные брома нестойки, йода не получены. Кислоты, содержащие галоген – галогенсульфоновые, например фторсульфоновая (фтортриоксосульфат (VI) водорода) HSO3F. Она устойчивая, очень сильная кислота в водном растворе. В свободном состоянии относится к классу суперкислот. Хлорсульфоновая кислота известна, это типичный реагент сульфирования в органической химии, довольно чувствительный к влаге (разлагается на кислоты), бромсульфоновая выделена при низкой температуре и легко разлагается, с выделением брома.
3.5.3 Селен, теллур, полоний.Элементы образуют диоксиды и триоксиды, достоверной информации по гидратированным оксидам полония и его анионным кислородным формам мало. Селен и теллур образуют соответственно селенистую и теллуристую кислоты. Первая известна в виде H2SeO3, вторая в виде гидрата переменного состава TeO2·xH2O.Селениты известны в виде как средних, так и кислых солей – гидроселенитов, теллуриты, по-видимому, известны только как триоксотеллураты (IV). Селен образует в состоянии 6+ селеновую кислоту H2SeO4, с теллуром ситуация сложнее. Реакция TeO3 c водой приводит к аллотелурровй кислоте – вязкой жидкости переменного состава, при разбавлении переходящую в ортотеллуровую кислоту H6TeO6. Метателлураты, происходящие от H2TeO4 известны в виде нерастворимых твердых солей типа BaTeO4, соответствующе гидротеллураты, по-видимому, растворимы и, вероятнее всего, быстро гидратируются в высшие формы кислоты и выпадают в виде осадков сложного состава.
3.6 Подгруппа азота. 3.6.1 Азот. Азот помимо кислот и соответствующих им анионов, образует три катиона в соединениях с водородом, которые следовало бы рассматривать в другом разделе, здесь же мы коснемся их «гидроксидов». Гидроксид аммония при низких температурах получен как гидрат аммиака NH3·H2O, в виде NH4OH он известен только в водном растворе:
NH3 + H2O ↔ NH4OH ↔ NH4+ + OH-
Для гидразина должно существовать два гидроксида, но оба они не получены, известен лишь нестойкий моногидрат. Известны «соответствующие» им соли гидразиния, например хлорид N2H5Cl и гидразония, сульфат N2H6SO4.
Наконец гидроксиламин (гидроксонитрид водорода) NH2OH, образует соли гидроксиламмония NH3OH+ (положительный заряд локализован на атоме азота, с которым связаны 3 атома водорода).
Свойства и структура бинарных соединений азота с кислородом весьма специфичны. Более-менее «приличным» соединением является только монооксид азота NO, склонный при охлаждении к незначительной димеризации. Это оказывает существенное влияние на кинетику его окисления кислородом (в некоторых источниках встречается утверждение, что реакция тримолекулярна, на деле это двух стадийный процесс, бимолекулярный на каждом этапе), которое ускоряется при охлаждении системы. Димер, в отличие от тетраоксида диазота N2O4, особого названия не имеет, поскольку даже в твердом состоянии превращение мономера неполное. Для диоксида азота применяют термин бурый газ (димер бесцветен), он является составляющей газообразных выбросов ряда химических производств («лисий хвост»), он же окрашивает разлагающуюся на свету бесцветную азотную кислоту в желтый цвет и придает ей весьма отвратительный запах. NO образует комплексы с d-металлами типа карбонилов – нитрозилы, задействуя три электрона в этих соединениях.
Вещество состава N2O (веселящий газ), является не оксидом азота (I), а оксонитридом азота со структурной формулой (в терминах классической теории валентности) N≡N→O или N≡N+-O-. Его можно получить термическим разложением нитрата аммония NH4NO3 или азотноватистой кислоты (диоксодинитрата (I) водорода H2N2O2), соли которой называются гипонитритами. Аналогично дифтордиазину она должна существовать в цис- и транс-формах, но в литературе подобного рода сведения отсутствуют. Вполне вероятно, что цис-вариант запрещен
Сескивоксид азота (азотистый ангидрид) смешанновалентный, в твердом состоянии это нитрит нитрозила NO+NO2-, сильно диссоциированная при обычных условиях, на оксиды в четных степенях окисления (связь N-N слабая) сине-зеленая жидкость, которую хранят в запаянных стеклянных ампулах. Ей отвечает известная только в водных растворах азотистая кислота (диоксонитрат (III) водорода HNO2). В солях азотистой кислоты (нитритах) активных металлов (например, щелочных) катионы (правильнее, конечно, говорить о локализации заряда, ибо в кристаллической ячейке ионного типа нет связей анион-катион) связаны с анионом через атом кислорода, в солях менее активных (например, серебра), через атом азота. В результате этого, получение органических нитросоединений R-NO2, содержащих связь C-N, по обменной реакции с легко доступными нитритами натрия или калия невозможно (продукты – нитрозоэфиры R–O-N=O). Катион NO+ называют катионом нитрозония, а группу нитрозильной. Среди наиболее известных производных – нитрозилгалогениды (иодид не получен) NOHal, а также нитрозилсерная кислота NOHSO4, обязательная примесь к серной кислоте получавшейся по нитрозному методу.
Пентаоксид азота (азотный ангидрид) представляет собой в твердом состоянии нитрат нитроила NO2+NO3-. Получены некоторые другие соединения этой группы – ионный перхлорат [NO2]+[ClO4]-, ковалентный нитроилфторид (диоксофторид) NO2F и такой же хлорид. В органической химии катион NO2+ принято называть катионом нитрония. HNO3 - азотная кислота, на свету разлагается окрашиваясь в бурый цвет NO2. В таком виде она называется дымящей (концентрация исходной кислоты должна быть высокой).
О пероксиде азота N2O6 и надазотной кислоте HNO4 сообщалось, но эта информация сомнительна.
3.6.2 Фосфор. Фосфины, в отличие от производных азота, с водой не реагируют и гидратов не образуют. При реакции диспропорционирования фосфора в щелочах, может быть получен гипофосфат (фосфинат, диоксодигидридофосфат (I)) бария.
3Ba(OH)2 + 6H2O + 2P4 → 3Ba(H2PO2)2 + 2PH3
Это средняя соль, поскольку в молекуле фосфорноватистой кислоты, два из трех атомов водорода связаны с центральным атомом фосфора (рис. 4а). Ей не соответствует никакое бинарное соединение фосфора с кислородом.
а) 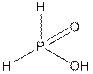 б)
б) 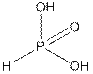 в)
в) 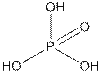
Рис.4 Кислоты фосфора а) фосфорноватистая б) ортофосфористая в) ортофосфорная
Оксид фосфора (III) (фосфористый ангидрид) имеет молекулярную формулу P4O6, но в тех случаях, когда отсылка к структуре неважна, ее упрощают до P2O3. С водой он образует ортофосфористую кислоту (рис. 4б), которая может давать как кислые соли (гидроортофосфаты (III), гидроксодииоксогидридофосфаты (III), NaH2PO3), так и средние (триоксогидридофосфаты (III) Na2HPO3).
Пентаоксид фосфора имеет молекулярную структуру P4O10, но, как и всегда, где это не существенно, особенно в общих схемах реакций, ее упрощают до P2O5. Отвечающие ему высшие кислоты фосфора приведены на рис. 4в и 5. Простейшая из них ортофосфорная (4в), тетраоксофосфат (V) водорода. Помимо средних солей, ортофосфатов (часто их называю просто фосфатами), образует два ряда кислых солей гидрофосфатов (гидроксотриоксофосфатов (V), Na2HPO4) и дигидрофосфатов (дигидроксодиоксофосфатов (V), NaH2PO4). Термин бифосфаты, как не указывающий на структуру соответствующего аниона, не применяется!
а) 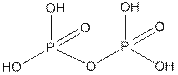 б)
б) 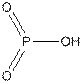
Рис. 5 Высшие кислоты фосфора а) пирофосфорная кислота б) мономер метафосфорной кислоты
Получаемые термическим разложением гидрофосфатов пирофосфаты, например натрия Na4P2O7 (гептаоксодифосфаты), довольно сложно получить в форме не средних, а кислых солей, но думается, тот, у кого достаточно ловкие руки и просветленный разум, чтобы получить чистый Na3HP2O7, не испытает трудностей с их названием.
Приведенная на рисунке 5б структура метафосфорной кислоты, отвечает простейшему случаю, не существующему в реальности (разве что в газовой фазе). Ее соли известны в виде производных полимерных ионов, циклических тетра- (PO3)44- и гексамеров- (PO3)66-, цепочечного полианиона (PO3)∞∞- и называются полиметафосфатами.
Помимо оксокислот фосфор образует фтороксокислоты: монофторфосфорную (триоксофторфосфорную) H2PO3F и дифторфосфорную (диоксодифторфосфорную) HPO2F2. Органические эфиры первой из них чрезвычайно токсичны, например диизопропилмонофторфосфат (i-C3H7O)2POF.
Предельным случаем замещения OH групп на галоген, являются оксотригалогениды, POHal3. Важный лабораторным методом получения, весьма полезного для нужд химика-органика, оксотрихлорида, является его получение из оксида и хлорида
P2O5 + 3PCl5 → 5POCl3.
Соответствующий иодид неизвестен.
3.6.3 Мышьяк, сурьма, висмут. Все три элемента образует сескви- и пентаоксиды. Для мышьяка известны соли метамышьяковистой (диоксоарсенаты (III), метаарсениты) HAsO2 и ортомышьяковистой (триоксоарсенаты (III), ортоарсениты) H3AsO3. кислот. В отличие от фосфора, все атомы водорода связаны с мышьяком через кислород. Сурьма и висмут в степени окисления 3+ образуют тригидроксиды. Им соответствуют полимерные и малоустойчивые антимониты (диоксостибаты), а также два устойчивых катиона антимонила (стибила) SbO+ и висмутила BiO+. Соли мета- HAsO3 (по всей видимости, мономерна) и ортомышьяковый H3AsO4 кислот известны, пироарсенаты не получены. Метаантимонаты SbO3- полимерны, ортоантимонаты SbO43- малохарактерны. Известен тригидроксид сурьмы Sb(OH)3 (катион дигидроксосурьмы (III) Sb(OH)2+ обезвоживается почти мгновенно, переходя в катион антимонила (стибила) SbO+), тоже касается и висмута (катион висмутила BiO+). Осадок переменного состава, получаемый водным или щелочным гидролизом пентахлорида сурьмы, называется α-сурьмяной кислотой Sb2O5·xH2O. Окисление сурьмы концентрированной азотной кислотой дает β-сурьмяную кислоту Sb2O5·yH2O (y<x), в которой часть связей OH заменена мостиковым кислородом. Тоже происходит при стоянии на воздухе (старение), когда часть воды теряется (дегидратация).
Для сурьмы известны гидроксоантимонаты тетра- [Sb(OH)4]- и гекса- [Sb(OH)6]-. Гексагидроксоантимонат натрия Na[Sb(OH)6] плохорастворим, что используется в аналитической химии при выявлении натрия. Висмутаты (V) по-видимому, известны только как триоксовисмутаты (V), к примеру, KBiO3.
3.7 Подгруппа углерода. 3.7.1 Углерод. Углерод образует три бинарных соединения с кислородом. Высший оксид CO2. помимо стандартных названий называют углекислым газом, или, говоря простым языком, углекислотой. Ему соответствует не полученная в чистом виде угольная кислота (известна только в растворе), которая образует два ряда солей карбонаты, соли иона CO32- и гидрокарбонаты (бикарбонаты) HCO3-. Соответствующая средняя соль натрия называется технической, а кислая – пищевой содой. Карбонат кальция – известь или известняк.
Карбонаты многих катионов, особенно высокозарядных сильно гидролизованы. Так медь образует минерал малахит (основной карбонат меди) (CuOH)2CO3, алюминий – даусонит (дигидроксокарбонат алюминия натрия) NaAl(OH)2CO3 – важный технический продукт при очистке алюминиевого сырья.
Оксид CO – угарный газ, окись углерода, традиционно относящийся в школьной литературе к нейтральным оксидам. Формиаты, соли одноосновной муравьиной (метановой) кислоты HCOOH относятся к органическим кислотам, и мы их рассмотрим в другом разделе. Восстановлением оксида калием получают вещество K6C6O6. По всей видимости, это калиевая соль гексагидроксобензола – органического вещества.
Существует целый класс соединений вида Mx(CO)y, зачастую весьма вычурного строения, называемых карбонилами (с формальной степенью окисления метала равной нулю). Если такой карбонил один, то его называют просто карбонилом элемента, для сложных случаев приходится прибегать к числительным, в т.ч. весьма нескромным, например гексадекакарбонил гексародия Rh6(CO)16. Существуют еще более вычурные случаи, например 1,2-μ-H-1,2-μ-ацилдекакарбонил триосмия (0) (рис. 6). Впрочем, для тех, кто не хочет плотно заниматься химией карбонилов, нет нужды углубляться в данные дебри.
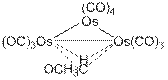
Рис. 6 1,2-μ-H-1,2-μ-ацилдекарбонил триосмия (0)
Для себя же отметим, что мостиковый атом или группа отмечается символом μ.
К органическим кислотам относится малоновая (пропандиовая) кислота CH2(COOH)2. Ее обезвоживание приводит к недоокиси углерода C3O2 (диоксид триуглерода) O=C=C=C=O.
Формальной степени окисления 3+ у углерода отвечает щавелевая (этандиовая кислота, средние соли оксалаты) (COOH)2. Выделить из нее соответствующий оксид нельзя – сначала она декарбоксилируется (теряет CO2), превращаясь в муравьиную, а та уже декарбонилируется (также важный термин в органической химии), теряя CO.
Оксид графита – вещество переменного состава, получающееся при окислении графита, к примеру, хромовой смесью. Это соединение содержит также и водород.
Известны средние соли динадугольной (пероксотетраоксодикарбонаты) H2C2O6 и мононадугольной H2CO4 (пероксодиоксокарбонаты) кислот.
3.7.2 Кремний. Низшие соединения кремния отвечают метастабильному монооксиду SiO и кремнещавелевой кислоте (SiOOH)2 (получают гидролизом гексагалогендисиланов). Производные диоксида (обычно называемого просто оксидом) кремния SiO2 – многочисленные силикаты. Пытаться хоть сколько-нибудь полно осветить эту химию и прорву названий, с учетом того, что в справочнике минералов из 7 томов, 2 посвящены силикатам, занятие абсолютно безнадежное. Еще более широк спектр различных силикатных стекол – веществ с неупорядоченной решеткой. Если в кристаллах мы можем выделить кусочек (элементарную ячейку), последовательным копированием и вставкой которого (трансляцией), мы можем описать весь объем (пренебрегая различного рода дефектами), то в стеклах мы можем говорить лишь о частных, упорядоченных малых областях пространства. Подобные системы описываются методами Вороного-Делонэ, но ни тематика, ни объем нашего издания, не предназначены для сколь ни будь подробного изложения этого вопроса.
Номенклатуру силикатных стекол пытались ввести педантичнее немцы в начале прошлого века, но даже у них это не получилось – слишком большое разнообразие. Мы здесь ограничимся лишь самыми общими словами.
Метакремниевой кислоте «H2SiO3» отвечает нерастворимый в воде полимер. Ортокремниевая кислота H4SiO4, хорошо растворима в воде, но довольно реакционноспособна и при стоянии превращается в метакремниевую с образованием коллоидных растворов. Гидраты окислов, которые бы соответствовали всему богатству силикатов (обычно называемых по соответствующим минералам), в чистом виде не получены. Коллоидные растворы метасиликатов калия и натрия, называют жидким стеклом, они же лежат в основе силикатного (канцелярского) клея.
3.7.3 Германий, олово, свинец. Стабильность низших монооксидов в ряду металлов возрастает, высших – диоксидов, падает. Смешанный оксид свинца (II, IV) Pb3O4 – свинцовый сурик. Гидраты высших окислов германия и олова находятся в тех же стехиометрических и химических соотношениях с греческим алфавитом, что и у сурьмы. Диоксид свинца гидратов не образует. Германаты (IV) подобны силикатам, но менее разнообразны, для них можно применять обычную номенклатуру. Соответствующие станнаты и плюмбаты – двойные оксиды. Германий и олово образуют гидроксоанионы типа [M(OH)6]2-, не представляющие трудностей, для олова известны и производные [Sn(OH)3]-. Монооксид германия гидратированной формы, по всей видимости, не имеет, дигидроксиды олова и свинца хорошо известны.
3.8 Подгруппа бора. 3.8.1 Бор. Помимо непосредственно сесквиоксида B2O3 и ортоборной кислоты B(OH)3, известны низшие соединения и пероксобораты, название которых не представляет сложностей. Ортоборная кислота не образует ни кислых, ни средних солей. Со щелочами она реагирует по схеме
NaOH + B(OH)3 → Na[B(OH)4]
Последние склонны к конденсации с образованием солей тетраборной кислоты Na2B4O7 (бура, выделяется из раствора в виде декагидрата). Соли неизвестной в свободном виде метаборной кислоты HBO2 содержат полимерный анион и могут переходить в стеклообразное состояние. Многие сорта силикатного стекла содержат в себе присадку B2O3. Известны и пероксобораты, которые вы легко назовете самостоятельно.
3.8.2 Алюминий.Алюминий в своих «обыденных» для лабораторной практики соединениях трехвалентен. Его оксид Al2O3 имеет две формы, маркируемые буквами греческого алфавита α и γ. В α-Al2O3 (минерал корунд), ионы кислорода образуют кубическую плотнейшую упаковку, в которой ионы Al3+ расположены в октаэдрический пустотах между ионами кислорода. В гамма-форме ионы алюминия лежат в тетраэдрических пустотах. Гидроксид алюминия (минерал гиббсит) Al(OH)3 амфотерен.
Al(OH)3 + 3NaOH → Na3[Al(OH)6]
Образование гекагидроксоалюминатов протекает через промежуточную стадию тетрагидроксоалюминатов, но последние, в целом, не характерны. Оксокатионы для алюминия неизвестны. Низший оксид алюминия (субоксид) Al2O – высокотемпературное метастабильное соединение.
Кроме простых алюминатов существует громадное <
Дата добавления: 2021-09-07; просмотров: 757;











