Классификация оксидов по химическим свойствам
Физические свойства оксидов
Температуры плавления и кипения оксидов меняются в очень широком интервале. При комнатной температуре они, в зависимости от типа кристаллической решетки, могут находиться в различных агрегатных состояниях. Это определяется природой химической связи в оксидах, которая может быть ионной или ковалентной полярной.
В газообразном и жидком состояниях при комнатной температуре находятся оксиды, образующие молекулярные кристаллические решетки. С увеличением полярности молекул температуры плавления и кипения повышаются, см. табл. 1.
Таблица 1
Температуры плавления и кипения некоторых оксидов
(давление 101,3 кПа)
| CO2 | CO | SO2 | ClO2 | SO3 | Cl2O7 | H2O | |
| Тпл., °C | – 78 (Твозгоки) | – 205 | – 75,46 | – 59 | 16,8 | – 93,4 | |
| Ткип., °C | – 191,5 | – 10,1 | 9,7 | 44,8 |
Оксиды, образующие ионные кристаллические решетки, например, CaO, BaO и др. являются твердыми веществами, имеющими очень высокие температуры плавления (> 1 000°C).
В некоторых оксидах связи ковалентные полярные. Они образуют кристаллические решетки, где атомы элемента связаны несколькими “мостиковыми” атомами кислорода, образуя бесконечную трехмерную сеть, например, Al2O3 , SiO2 , TiO2 , BeO и эти оксиды тоже имеют очень высокие температуры плавления.
Классификация оксидов и закономерности изменения химических свойств
Классификация оксидов по химическим свойствам
По химическим свойствам оксиды разделяются на следующие типы:
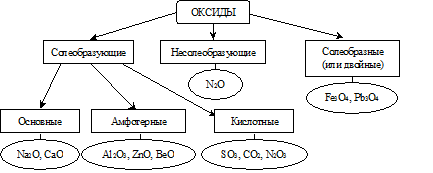
Несолеобразующими называются оксиды, которым не соответствуют ни кислоты, ни основания.
Солеобразными оксидами называются двойные оксиды, в состав которых входят атомы одного металла в разных степенях окисления.
Металлы, проявляющие в соединениях несколько степеней окисления, образуют двойные, или солеобразные оксиды. Например, Pb3O4 , Fe3O4 , Mn3O4 (формулы этих оксидов могут быть записаны также в виде 2 PbO × PbO2 ; FeO × Fe2O3 ; MnO × Mn2O3 соответственно).
Например, Fe3O4 Þ FeO × Fe2O3 : представляет собой основный оксид FeO химически связанный с амфотерным оксидом Fe2O3 , который в данном случае проявляет свойства кислотного оксида. И Fe3O4 формально можно рассматривать как соль, образованную основанием Fe(OH)2 и кислотой [HFeO2 ], которая не существует в природе:
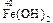 + 2 [
+ 2 [ 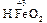 ] =
] = 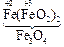 + H2O.
+ H2O.
От гидрата оксида свинца (IV), как от кислоты, и Pb(OH)2 , как основания, могут быть получены два двойных оксида — Pb2O3 и Pb3O4 (сурик), которые можно рассматривать как соли. Первый является свинцовой солью метасвинцовой кислоты (H2PbO3), а второй — ортосвинцовой кислоты (H4PbO4).
Cреди оксидов, особенно среди оксидов d-элементов, много соединений переменного состава (бертолиды), содержание кислорода в которых не соответствует стехиометрическому составу, а изменяется в довольно широких пределах, например, состав оксида титана (II) TiO изменяется в пределах TiO0,65 – TiO1,25 .
Солеобразующими оксидами называются оксиды, которые образуют соли. Оксиды этого типа делятся на три класса: основные, амфотерные и кислотные.
Основными оксидами называются оксиды, элемент которых при образовании соли или основания становится катионом.
Кислотными оксидами называются оксиды, элемент которых при образовании соли или кислоты входит в состав аниона.
Амфотерными оксидами называются оксиды, которые в зависимости от условий реакции могут проявлять как свойства кислотных, так и свойства основных оксидов.
При образовании солей степени окисления элементов, образующих оксиды, не изменяются, например:
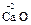 +
+  =
= 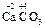 .
.
Если при образовании соли происходит изменение степеней окисления элементов, образующих оксиды, то получившуюся соль следует отнести к соли другой кислоты или другого основания, например,
а) 2 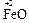 + 4
+ 4 
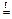
 +
+ 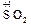 .
.
Fe2(SO4)3 представляет собой соль образованную серной кислотой и гидроксидом железа (III) — Fe(OH)3 , которому соответствует оксид Fe2O3 .
б) 2 KOH + 2  =
= 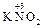 +
+ 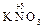 + H2O.
+ H2O.
Образовавшиеся соли являются солями азотистой ( 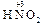 ) и азотной (
) и азотной ( 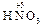 ) кислот, которым соответствуют оксиды
) кислот, которым соответствуют оксиды
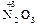 и
и 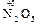 .
.
Дата добавления: 2021-09-07; просмотров: 446;











