Металлический тип связи в кристаллах
Что такое металл? В химии металл – это элемент, у которого на внешней электронной оболочке находится 1, 2 или 3 электрона, они относительно легко отрываются от атома, который становится положительным ионом.
В технике – это материалы, обладающие высокой тепло- и электропроводимостью, очень пластичны и имеют металлический блеск.
В твердом состоянии металлы имеют кристаллическое строение. Какими силами связаны атомы в кристаллической решетке?
Существует три главных типа связи в кристаллической решетке: металлический тип связи (между атомами металлов); ионный – (между атомами металлов и неметаллов); ковалентный (между атомами неметаллов).
Рассмотрим только металлический тип связи, благодаря которому металлы приобретают присущие им свойства.
В узлах кристаллической решетки металлов находятся положительные ионы, а внешние (валентные) электроны образуют электронный «газ» (рис. 1.1). Атомы в решетке связаны силами взаимного притяжения и отталкивания между положительно заряженными ионами и электронным «газом». Такая связь не является жесткой и направленной, поэтому атомы могут скользить друг относительно друга, не нарушая сплошности материала, что и обеспечивает высокую пластичность металлов (рис. 1.2). Наличие электронного «газа» обеспечивает электро- и теплопроводность металлов.
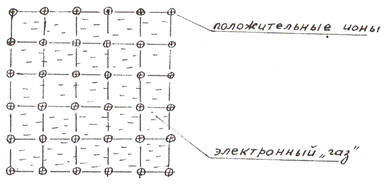
Рис. 1.1. Схема металлического типа связи в кристаллической решетке
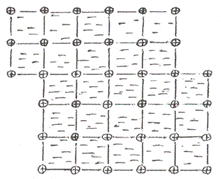
Рис. 1.2. Схема сдвига в решетке металла при пластической деформации
Металлическим типом связи объясняется несложность и плотная упаковка в кристаллической решетке металлов.
У металлов, в основном, наблюдается всего три типа кристаллических решеток (рис. 1.30):
- гранецентрированная кубическая (ГЦК) – Cu, Al, Pt, Ni, Fe 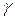 , Co
, Co 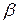 , Ag, Au и др.;
, Ag, Au и др.;
- объемноцентрированная кубическая (ОЦК) – Mo, Fe 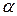 , V, Nb, Na, Ti
, V, Nb, Na, Ti 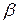 , Zr
, Zr 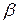 , Cr, Ta, K, Li, W и др.;
, Cr, Ta, K, Li, W и др.;
- гексагональная плотноупакованная (ГПУ) – Mg, Ti 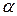 , Be, Y, Zr
, Be, Y, Zr 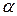 , H, Co
, H, Co 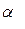 , Cd и др.
, Cd и др.
Некоторые металлы изменяют свою кристаллическую решетку в зависимости от внешних условий (температуры и давления) – это явление называется полиморфизмом или аллотропией. Например,( при атмосферном давлении) до 8820 С существует Ti 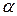 c ГПУ- решеткой. А при более высокой температуре - Ti
c ГПУ- решеткой. А при более высокой температуре - Ti 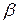 c ОЦК- решеткой. Аллотропию имеют Fe, Co, Ca, Ti, Sn и др.
c ОЦК- решеткой. Аллотропию имеют Fe, Co, Ca, Ti, Sn и др.
Размеры элементарной ячейки называются параметрами, которые обозначаются а, b,С (см. рис. 1.3) и измеряются в ангстремах (10А=10-8 см) или в нанометрах (1нм 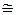 100А=10-9м).
100А=10-9м).
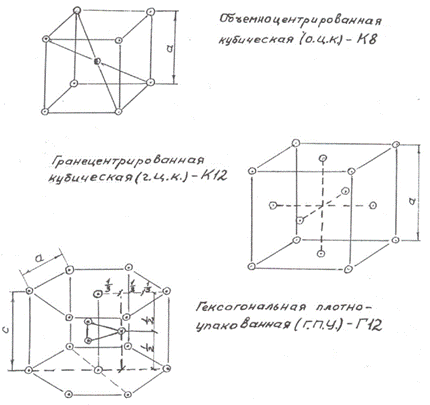
Рис. 1.3. Схемы элементарных ячеек металлов.
Кристаллические решетки принято также характеризовать координационным числом, которое указывает на число атомов, расположенных на ближайшем одинаковом расстоянии от любого атома в решетке. Чем выше координационное число, тем больше плотность упаковки атомов. Наиболее плотно упакованы решетки ГЦК (К120 и ГПУ (Г12); ОЦК имеет координационное число 8 (К8).
Свойства каждого тела в значительной степени определяются силой взаимодействия между атомами, которая зависит от расстояния между ними. Если в жидкости и газе расстояния между атомами не зависят от направления, то в кристаллах определяются кристаллографические направления. На рис. 1.4 изображена схема кубической решетки и обозначены три различных направления, по которым будем прикладывать растягивающие усилия. Очевидно, что деформация кристалла начнется по этим направлениям при разных усилиях.
Рис. 1.4. Схематическое изображение анизотропности в кристаллах
Зависимость свойств от направления называется анизотропией.
Газы, жидкости и аморфные тела изотропны, т.е. свойства не зависят от направления (изо – одинаковый; ан – не). В кристаллах от направления зависят не только механические, но и физические, химические свойства. В поликристаллических телах, состоящих из миллионов кристалликов, расположенных неориентировано, свойства выравниваются по направлениям. Такие тела – квазиизотропны (квази – как бы). Однонаправленность кристаллитов в поликристаллическом теле называется текстурой. Текстурированный металл также анизотропен.
Дата добавления: 2017-01-26; просмотров: 2457;











