Взаимодействие металлических и шлаковых расплавов
При взаимодействии металлических и шлаковых расплавов протекают важные физико-химические процессы такие, как окисление, легирование, модифицирование, раскисление, науглероживание, десульфурация, дегазация, удаление неметаллических включений. Эти процессы протекают в сложной системе при взаимодействии нескольких фаз различной физико-химической природы.
В результате химического взаимодействия между шлаком и жидким металлом изменяется химический состав и шлака, и металла. Например, после образования шлакового покрова прекращается непосредственное взаимодействие жидкого металла с окислительной атмосферой. Однако окисление элементов химического состава сплава продолжается за счет их взаимодействия с закисью железа FeO, находящейся в шлаке, по реакциям:
Si+2FeO = SiO2+ 2Fe,
Mn + FeO = MnO +Fe,
C + FeO = CO + Fe.
Эти реакции протекают потому, что химическое сродство окисляемых элементов к кислороду выше, чем у железа.
За счет взаимодействия металлического и шлакового расплавов происходит не только окисление элементов сплава, но и удаление растворенного в жидком металле кислорода. Эта операция называется раскислением. Процессы окисления и раскисления определяются составом и свойствами газовой фазы.
Термодинамической характеристикой состава и свойств газовой фазы может служить химический потенциал компонента газовой фазы, измеренный относительно стандартного состояния μ°.
Разность химических потенциалов кислорода при стандартном состоянии, когда давление равно 1 атм., и при любом другом давлении 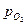 называется кислородным потенциалом:
называется кислородным потенциалом:
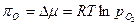 . (53)
. (53)
При изотермическом переходе моля кислорода от давления 1 атм. к давлению 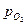 кислородный потенциал равен изменению свободной энергии системы:
кислородный потенциал равен изменению свободной энергии системы: 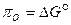 . (54)
. (54)
Для любого оксида реагирующего компонента:
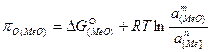 , (55)
, (55)
где a – активности оксида в шлаке и металла; n и m – стехиометрические коэффициенты реакций образования оксидов, отнесенные к молю реагирующего вещества.
Кислородный потенциал 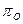 по мере увеличения прочности оксида (
по мере увеличения прочности оксида ( 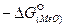 ) уменьшается, а затем понижается с уменьшением активности оксида в шлаке а(МеО) и увеличением активности элемента в металле а[МеО].
) уменьшается, а затем понижается с уменьшением активности оксида в шлаке а(МеО) и увеличением активности элемента в металле а[МеО].
В газовой фазе кислородный потенциал может быть выражен через парциальные давления:
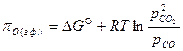 . (56)
. (56)
Условием окисления примесей металлической ванны является наличие кислородного потенциала окислителя, превышающего кислородный потенциал оксидов компонентов. При окислении железа, марганца и кремния должно быть обеспеченно неравенство
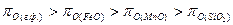 .
.
Степень полноты окисления элементов вытекает из равенства, которое может быть достигнуто в условиях равновесия:
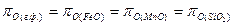 .
.
Чем меньше значение 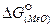 и больше прочность оксида, тем полнее пройдёт окисление того или иного элемента и большим будет соотношение
и больше прочность оксида, тем полнее пройдёт окисление того или иного элемента и большим будет соотношение 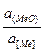 .
.
Последовательная завершенность процессов окислительных элементов можно установить на основании сравнения величин изменения свободной энергии образования различных оксидов ( 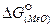 ).
).
В реальных условиях работы плавильных агрегатов в газовой фазе и шлаке поддерживается окислительный потенциал, значительно превышающий потенциал окисляемых элементов. В таких условиях реакции окисления нескольких элементов протекают одновременно, но с различными кинетическими возможностями.
В целом процесс окисления складывается из следующих элементарных процессов:
- передача окислителя из газовой фазы к шлаковой или металлической;
- преодоление межфазных границ газ - шлак или шлак – металл;
- диффузия окислителя в шлаковой или металлической фазах;
- перенос элемента к реакционной зоне;
- адсорбция элементов в реакционной зоне;
- химическое взаимодействие между окислителем и элементом;
- зарождение и развитие новой фазы из продуктов химического взаимодействия;
- удаление новой фазы из реакционной области.
Скорость суммарного процесса всегда определяется процессом, протекающим с минимальной скоростью.
ФИЗИКО – ХИМИЧЕСКИЕ ПРОЦЕССЫ ПРИ ПЛАВКЕ СТАЛИ
Этапы плавки стали
Цикл плавки стали в электродуговых печах по времени можно разделить на 3 этапа:
1 - Период расплавления шихты. Начинается примерно с момента завалки шихты в печь и заканчивается в момент полного ее расплавления. Длительность периода зависит от состава и состояния шихты и от интенсивности подвода тепла.
2 - Период окисления, в течение которого из расплава удаляется основания часть сопутствующих элементов и газы (частичное окисление сопровождающих элементов происходит еще в период расплавления шихты).
3 - Период окачивания плавки – доводка. В течение этого периода из стали удаляется сера и производится раскисление и легирование стали.
В течение всего процесса плавки идёт химическое взаимодействие между печной атмосферой и шлаком, шлаком и расплавом, а также непосредственно в шлаке и расплаве.
В течение плавки в печи должны быть созданы условия, необходимые для снижения содержания нежелательных элементов до минимума и обеспечения заданного химического состава.
Большинство сопутствующих элементов можно удалить путём окисления. Образующиеся при этом оксиды переходят в шлак. Для получения достаточной степени окисления сопутствующих элементов в печи должно быть соответствующее количество кислорода, который находится в виде различных оксидов, содержащихся в шихте, и виде кислорода воздуха. В процессе плавки кислород вводится в печь путем добавления железной и марганцевой руды, которые являются оксидами, либо через расплавленный металл продувают кислород.
Очередность окисления элементов зависит от их сродства к кислороду. Сродство элементов к кислороду изменяется в зависимости от температуры, концентрации веществ и характера среды, в которой происходит окисление. В условиях плавки стали в электродуговой печи элементы по их сродству к кислороду можно расположить в следующий ряд:
Ca, Mg, Al, Ti, Si, V, Mn, P, Cr, Fe, S, W, Ni, Mo, Co, Cu.
Слева направо сродство элементов к кислороду уменьшается. Путем окисления из стали можно удалить те элементы, которые имеют большее сродство к кислороду, чем железо. Примерно в таком же порядке происходит выгорание элементов при плавке. При этом строгая последовательность не соблюдается, отдельные фазы окисления перекрываются.
Окисление углерода
Окисление углерода является важнейшим процессом при производстве стали. По отношению к другим элементам окисление углерода происходит в последнюю очередь. Этот процесс описывается уравнением
[C] +[O] = {CO}, ∆H = - 34,7 кДж.
В результате реакции образуется газообразный СО, который в виде пузырьков удаляется из ванны в печную атмосферу и вызывает так называемое «кипение» ванны. Это означает, что выгорание всех помесей, кроме углерода, окончено и начинает выгорать углерод, который таким образом восстанавливает железо из оксида FeO, содержащегося в расплавленном металле.
В результате протекания реакции окисления углерода нарушается равновесие между содержанием FeO в шлаке и расплаве. В соответствии с законом распределения начинается диффузия FeO из шлака в расплав. Процесс диффузии FeO эндотермический (∆H = 114, 9 кДж).
В целом процесс окисления углерода можно описать уравнениями:
(FeO) → [FeO],
[FeO] + [C] = [FeO] + [CO],
[CO] → {CO}.
Результирующая реакция
(FeO) + [C] = [Fe] + {CO}.
В связи со значительным эндотермическим эффектом перехода FeO из шлака в расплав реакция окисления углерода является эндотермической.
Лимитирующим фактором реакции обезуглероживания является скорость диффузии FeO из шлака в расплав. Кроме FeO в процессе выгорания углерода в металлической ванне принимает участие растворенный в ней оксид марганца MnO:
[ MnO] + [C] = [Mn] + {CO}.
Концентрация MnO в расплаве снижается, равновесие между MnO в шлаке и расплаве нарушается, и MnO переходит из шлака в расплав.
С повышением температуры скорость окисления углерода увеличивается. При повышении температуры повышается сродство углерода к кислороду. Следовательно, при высоких температурах углерод может восстанавливать почти все оксиды.
Кипение ванны, обусловленное реакцией окисления углерода, оказывает исключительное влияние на качество металла. При плавке стали необходимо, чтобы кипение ванны было интенсивным и достаточной продолжительным. В процессе кипения из ванны удаляются газы, включения, интенсифицируется теплообмен, быстрее перемещаются реагирующие вещества, благодаря чему быстрее протекают металлургические реакции.
Для обеспечения интенсивности кипения ванны необходимо, чтобы она содержала достаточное количество углерода и кислорода и была нагрета до высокой температуры (более 1500…1510°С). Если в ванне мало углерода, то очень трудно разогреть ванну до необходимой температуры. Поэтому для повышения температуры ванны и перевода ее в состояние кипения в нее добавляют С и Mn в виде передельного или зеркального чугуна.
Благоприятные условия для окисления углерода наступают, когда в ванне закончится окисление Si, Mn, P. В этот период кипение ванны интенсифицируется путем добавления в неё кислорода.
Окисление кремния
При содержании в ванне жидкого железа более 0,05% Si его окисление протекает по следующей реакции:
[Si] + 2 (FeO) = (SiO2) + 2[Fe]; ∆H = - 330,178 кДж/моль.
Образующаяся двуокись кремния SiO2 в железе практически не растворяется. Этот оксид связывается избыточным FeO с образованием низкоплавкого силиката железа по уравнению:
SiO2 + 2 FeO = (FeO)2·SiO2; ∆H = - 244,8 кДж/моль.
Реакция окисления кремния сопровождается выделением большого количества теплоты. В соответствии с принципом Ле – Шателье протеканию реакции способствует пониженная температура, характерная для периода расплавления шихты и начала окислительного периода. В течение окислительного периода содержание кремния в металлической ванне в основной печи снижается до 0,01%.
Если система была в равновесии, то нагрев приводит к обратному переходу кремния из шлака в металл. При содержании кремния свыше 4% его раскислительная способность уменьшается.
Когда процесс окисления кремния является основным, он обеспечивает расплав требуемым количеством теплоты, что обуславливает рациональное ведение последующих операций. С переходом на кислородное дутье роль кремния значительно уменьшилась. В настоящее время возможен передел в сталь чугуна, содержащего 0,5…0,6% Si.
Если окисление Si происходит в основной печи, то ванна железа находится под основным шлаком, содержащим основные оксиды, преимущественно CaO. Так как оксид кальция является более сильным основанием, чем оксид железа FeO, он вытесняет FeO из соединения с кремнием по уравнению
(FeO)2·SiO2 + 2 CaO = (CaO)2·SiO2 + 2 FeO; ∆H = - 117,34 кДж/моль.
Эта реакция протекает исключительно в шлаке, в нем повышается содержание FeO. Вследствие этого нарушается равновесие между содержанием FeO в шлаке и металлической ванне, и FeO переходит из шлака в ванну.
Образующийся силикат кальция является очень стабильным соединением и в основной печи практически не разлагается присутствующими в ванне компонентами. Поэтому восстановление кремния из шлака практически невозможно.
Если окисление кремния происходит в кислой печи, то ванна железа находится под кислым шлаком, содержащим преимущественно SiO2, очень мало CaO. В таких условиях образовавшийся оксид SiO2 в шлак из расплава не переходит, а взаимодействует с железом, происходит восстановление кремния из оксида по уравнению:
SiO2 + 2[Fe] = Si + 2 [FeO].
Образовавшийся оксид FeO в ванне немедленно восстанавливается углеродом с образованием железа и оксида углерода:
[FeO] + [С] = [Fe] + {CO}.
Количество восстановленного кремния будет тем больше, чем выше температура ванны, чем меньше концентрация FeO или кислорода в ванне и чем меньше значение константы равновесия КSi:
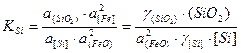 .
.
В уравнении константы равновесия реакции окисления кремния принято, что активность растворителя, то есть железа, близка к единице аFe≈1; активности оксида кремния и кремния выражены через их коэффициенты активности и массовые доли.
Коэффициент распределения
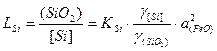 ,
,
где  - коэффициент активности, когда за стандартное состояние чистого вещества принимают реальное состояние, для раствора выполняется закон Рауля;
- коэффициент активности, когда за стандартное состояние чистого вещества принимают реальное состояние, для раствора выполняется закон Рауля; 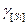 - в качестве стандартного принято условное состояние вещества, раствор подчиняется закону Генри.
- в качестве стандартного принято условное состояние вещества, раствор подчиняется закону Генри.
Окисление марганца
Окисление марганца в расплаве железа можно представить реакцией
[Mn] + (FeO) = (MnO) + [Fe]; ∆H = - 126,8 кДж/моль.
Эта реакция протекает в основном на границе шлак-металл, может протекать внутри металлической ванны. Но с учетом присутствия других элементов, особенно кремния и углерода, в ванне для окисления марганца нет достаточного количества FeO. Так как реакция окисления марганца экзотермическая, то она активно протекает в начальный период плавки, когда температура ванны еще относительно невысокая.
В сталеплавильных процессах в начальный период наблюдается интенсивное окисление марганца и переход его в шлак. Содержание марганца в металле на момент расплавления шихты мало. В дальнейшем по мере разогрева ванны концентрация марганца в металле повышается, происходит обратный переход его из шлака.
Образующийся MnO является основным оксидом с температурой плавления 3058 К. При температурах процесса плавки стали MnO находится в твердом нерастворимом состоянии. Удаление MnO из ванны жидкого железа возможно в результате образования ряда твердых растворов с FeO, температура плавления которых снижается по мере увеличения соотношения MnO/FeO. При определенном содержании FeO частицы твердого раствора плавятся и всплывают в шлак.
Окисление марганца и склонность его к переходу в шлаковую фазу находятся в зависимости от основности шлака.
Для реакции окисления марганца константа равновесия
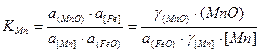 .
.
Коэффициент распределения
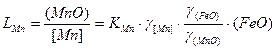 .
.
Для оксидов марганца и железа, находящихся в шлаке, за стандартное состояние вещества принято реальное состояние, для раствора выполняется закон Рауля; для марганца (примесь в расплаве железа) в качестве стандартного принято условное состояние вещества, раствор подчиняется закону Генри.
Так как оксиды марганца и железа являются основными оксидами, изменение состава шлака приводит к изменению активности γ(FeO) и γ(MnO) в одном направлении. Следовательно, основность шлака не так резко влияет на величину коэффициента распределения, как в случае кремния.
Практически установлено, что в кислом процессе марганец окисляется полнее, чем в основном. Это объясняется тем, что с ростом концентрации SiO2 в шлаке увеличивается соотношение γ(FeO)/γ(MnO).
Дефосфорация
Фосфор в углеродистой стали вызывает ее повышенную хрупкость на холоде, хладноломкость или синеломкость, ухудшает механические свойства стали. Допустимое содержание фосфора в стали менее 0,02…0,05%.
Фосфор обладает большим химическим сродством к кислороду, чем железо, и его можно удалять из расплава методом окислительного рафинирования.
Окисление фосфора происходит в два этапа. На первом этапе фосфор окисляется в ванне по уравнению:
2 [Р] + 5 [FeO] = (Р2O5) + 5 [Fe]; ∆H = - 200,97 кДж/моль.
Образовавшийся оксид фосфора Р2O5 образует с избыточным FeO фазу, имеющую состав, близкий к фосфату железа:
(Р2O5) + 3 (FeO) = (FeO)3·Р2O5; ∆H = - 128,5 кДж/моль.
Так как реакция экзотермическая, она протекает при относительно низких температурах. При высоких температурах фосфат железа нестабилен и появляется опасность восстановления фосфора и перехода его в ванну. Чтобы предупредить обратную реакцию, необходимо перевести Р2O5 в стабильное соединение, из которого фосфор восстанавливаться не будет.
Второй этап окисления фосфора осуществляется при помощи извести. При этом образуется фосфорно-кальциевая соль по уравнению:
(FeO)3·Р2O5 + 4 СаО = (СаО)4·Р2O5 + 3 FeO; ∆H = - 546,41 кДж/моль.
Если в шлаке мало СаО, то в первую очередь он будет соединяться с оксидом кремния и его не хватит для связывания фосфора. Считают, что извести в шлаке должно быть по массе в четыре раза больше, чем кремния и фосфора в шихте.
Из кинетических факторов, обеспечивающих успешную дефосфорацию в реальных условиях плавки, большое значение имеет перемешивание шлака, поскольку лимитирующим является процесс диффузии.
Восстановлению фосфора из шлака при высоких температурах могут способствовать элементы, которые при данных условиях имеют большее сродство к кислороду, чем железо, то есть все раскисляющие элементы. В период окончания плавки это главным образом марганец, кремний, алюминий.
Шлак, содержащий фосфор, который извлечен из расплава, перед раскислением удаляют (полностью или частично).
Десульфурация
При отвердевании стали в результате избирательной кристаллизации сера, растворенная в расплавленном металле, концентрируется в остающейся жидкости. Обладая очень малой растворимостью в железе, сера выделяется на границах зёрен металла в виде легкоплавких соединений в смеси с оксидами железа. Сталь с повышенным содержанием серы становится красноломкой – хрупкой при температурах горячей обработки (800-1000°С) а в холодном состоянии сталь имеет низкую механическую прочность.
При производстве литейных сплавов сера может находиться в газовой фазе (SO2), в топливе (FeS), в металлическом и шлаковом расплавах. Удалить серу из металла методом окислительного рафинирования невозможно, так как сера обладает меньшим сродством к кислороду, чем железо.
Десульфурация расплавленного металла производится переводом серы в шлак при помощи реагентов, способных давать более прочные и существенно менее растворимые в железе сульфиды, чем FeS, например CaS, MgS, MnS, Na2S и др. В качестве такого реагента чаще всего используют оксид кальция CaO.
В плавильных агрегатах процесс сводится к взаимодействию шлака, содержащего CaO, с металлом по реакции
[FeS]+(CaO)=(FeО)+(CaS),
которая является частным случаем взаимодействия серы, растворенной в железе, с основными оксидами шлака
[FeS]+(МеO)=(FeО)+(МеS).
Константа равновесия
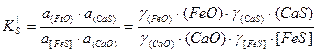 .
.
Концентрации (CaS) и [FeS] можно заменить общим содержанием серы в шлаке (S) и расплаве [S] с введением коэффициентов активности серы в шлаке γ(S) и расплаве γ[S], учитывающих в суммарном виде степень связанности серы в соответствующих фазах. Тогда
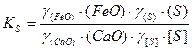 .
.
Коэффициент распределения 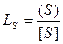 .
.
Эта величина служит для оценки обессеривающей способности шлака.
Из уравнения константы равновесия
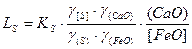 .
.
Отсюда следует, что константа распределения серы LS возрастает с увеличением активности СаО, то есть основности шлака, и со снижением активности FeO, то есть его окислительной способности.
Таким образом, для обессеривания наиболее пригодны основные восстановительные процессы.
В электросталеплавильном процессе после завершения окислительного рафинирования наводят раскислительный шлак с низким содержанием FeO (менее 1%) путём введения восстановителей (C и Si). Это обеспечивает и раскисление и десульфурацию стали.
Обессеривающая способность шлака зависит от его химического состава. Из всех компонентов шлака наиболее существенно влияют на обессеривающую способность оксиды кальция и кремния. CaO ее увеличивает; SiO2 уменьшает. Поэтому обессеривающую способность шлака оценивают отношением: 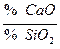 . Чем больше отношение, тем выше константа распределения
. Чем больше отношение, тем выше константа распределения 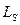 . Температура влияет на
. Температура влияет на 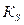 и
и 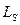 незначительно.
незначительно.
Процесс десульфурации определяется в значительной степени кинетикой взаимодействия. Чем быстрее идёт процесс, тем ближе система к состоянию равновесия и полнее используется обессеривающая способность шлака.
Большое значение имеют интенсивность перемешивания и вязкость шлака. Скорость процесса десульфурации возрастает по мере увеличения интенсивности перемешивания металла и шлака, а также понижения вязкости шлака, что может быть достигнуто повышением температуры и введением разжижающих добавок. Такой эффект связан с тем, что десульфурация расплавов железа протекает в диффузионной области и основным лимитирующим звеном процесса является переход серы из металлического расплава в шлак.
Раскисление
Раскисление - это заключительная технологическая операция плавильного процесса. Она проводится для того, чтобы снизить до минимума содержание кислорода, остающегося в расплаве после окислительного рафинирования. Кислород необходимо перевести в соединения, которые должны быть удалены из расплава.
Критерием раскислительной способности того или иного элемента является активность кислорода в металле, которая находится в равновесии с определенной концентрацией (активностью) элемента раскислителя и с продуктами раскисления, образуемыми раскислителем с кислородом.
При одновременном использовании нескольких раскислителей раскислительная способность каждого из них может увеличваться. Известно, что марганец и кремний взаимно усиливают раскислительную способность друг друга.
При выборе раскислителей необходимо отдавать предпочтение тем элементам, которые образуют оксиды, взаимодействующие между собой с образованием соединений с невысокой температурой плавления, желательно ниже температуры раскисляемого сплава, и плотностью намного меньше плотности сплава.
Требования, предъявляемые к раскислителям:
- при возможно малых концентрациях они должны обладать в условиях раскисления большим сродством к кислороду, чем раскисляемый Ме;
- остающиеся в расплаве раскислители не должны оказывать вредного влияния на свойства сплава;
- оксиды, образованные раскислителем, должны в минимальной степени растворяться в раскисляемом металле;
- нерациональные потери раскислителя должны быть минимальны;
- раскислители должны быть дешевыми и недифицитными.
Для раскисления железоуглеродистых сплавов используют C, Mn, Si, Al, Ti, Ca и др.
Процесс удаления продуктов раскисления связан не только с их природой, но и со многими побочными факторами: глубина ванны, высота ковша и др.
Эффективным средством раскисления сплавов является использование вакуума. В вакууме усиливается раскислительная способность элементов и создаются благоприятные условия для дегазации и удаления неметаллических включений. Но в вакууме возникает опасность взаимодействия жидкого металла с оксидами огнеупорных материалов футеровки.
Дата добавления: 2017-05-02; просмотров: 2672;











