Особенности коррозии паяных соединений
Для большинства металлов ионное состояние (руды металлов в форме оксидов, сульфидов, карбонатов, силикатов и других соединений) характеризуется меньшей внутренней энергией, является более устойчивым, и энергетически более выгодным (рис. 2.22), чем состояние элементарного металла.
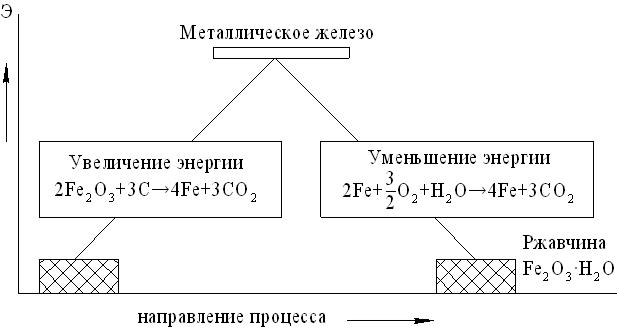
Рис. 2.22. Схема восстановления металла из руд и последующего окисления (коррозии): Э – условный уровень энергии
Свободный металл в агрессивной среде также стремится перейти в энергетически более выгодное состояние с меньшим запасом энергии, т.е. образовывать соединения, в которых металл находится в ионном состоянии (оксид, соль и т.д.). Например, железо при контакте с водой, содержащей газообразный кислород, превращается в оксид типа Fe2 O3 H2O, называемый ржавчиной.
Под влиянием химического, биохимического или электрохимического воздействия внешней среды наблюдается разрушение металлической конструкции вследствие коррозии. Коррозионный процесс заключается в переходе атомов из кристаллической решетки в ионное состояние, в результате происходит постепенная, а иногда и достаточно резкая потеря основных функций конструкции.
В общем случае электрохимический процесс состоит из следующих элементарных реакций:
а) анодное растворение металлов, например, 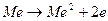 (окисление);
(окисление);
б) катодное восстановление растворенных окислителей (кислородная коррозия) 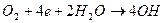 ;
;
в) выделение водорода (кислотная коррозия): 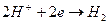 .
.
Окисление металла представляет собой реакцию, сопряженную с восстановлением окислителя или нескольких окислителей. Без этого невозможно самопроизвольное окисление металлов, т.е. коррозия.
Анодный процесс заключается в непосредственном переходе атома металла в раствор в виде гидратированных ионов либо через предварительное образование поверхностных промежуточных неустойчивых комплексных соединений или более стабильных соединений (типа оксидов или гидроксидов).
Основными катодными реакциями при коррозии металлов являются выделение водорода и восстановление растворенного кислорода. Коррозия с выделением водорода наблюдается только для металлов с довольно отрицательным равновесным потенциалом – Zn, Fe и др. При контакте с воздухом имеет место кислородная коррозия, наблюдаемая чаще всего в нейтральных растворах (атмосферная коррозия).
Практически все промышленные металлические сплавы разрушаются в агрессивных средах, поэтому ставить задачу создания абсолютно стойкой против коррозии конструкции неправомерно. Речь должна идти о путях и мерах существенного уменьшения коррозионного износа.
Металл является термодинамически нестабильной формой в обычных условиях и тенденция его к изменению химических форм (в среде электролита это электрохимическая коррозия) характеризуется изменением изобарно – изотермического потенциала GT; его можно представить в виде следующего выражения:
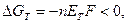
где n – число z – эквивалентов металла Ме; Е = (φ k) обр – (φ а) обр – электродвижущая сила гальванического элемента, в котором обратимо осуществляется данный процесс; (φ а) обр = (φ Ме) обр – обратимый потенциал металла в данных условиях; F – число Фарадея.
Условия самопроизвольного протекания коррозионного процесса определяются как
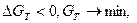
где ∆ GТ – уменьшение свободной энергии (изобарно-изотермического потенциала Гиббса) в данном коррозионном процессе:
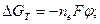
n e – число электронов, принимающих участие в реакции.
Изменение электрохимического потенциала (в данном случае электродного потенциала) ∆φ связано с потенциалом Гиббса зависимостью
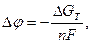
где n – количество грамм – эквивалента вещества.
Известно, что при погружении металла в электролит возникает разность потенциалов между ним и электролитом, называемая потенциалом металла. При электрохимической коррозии величина электродного потенциала металла оказывает определяющее влияние. Разность потенциалов, обусловливающая ток в коррозионном элементе, связана не только с различием металлов, образующих этот элемент. В общем виде она зависит от различия физико-химического состояния электродов, погруженных в электролит, т.е. коррозионный элемент может быть образован электродами из одного и того же металла при условии, что физико-химические условия их взаимодействия с электролитом будут разными. Это различие может быть связано с состоянием металла (например, различные обработки поверхности, микроструктура, степень наклепа и др.) и с составом электролита (разные концентрации солей, концентрация кислорода, скорость движения и др.). Значение и знак потенциала определяются самим металлом (химический состав, структура, состояние поверхности и др.), химическим составом электролита и условиями его взаимодействия на металл (температура, перемешивание). Установившееся значение потенциала называется стационарным потенциалом металла в данном электролите. Разрушение металла проявляется на более активных анодных участках, имеющих низкий по отношению к другому участку электрохимический потенциал; на катодных участках существенных потерь
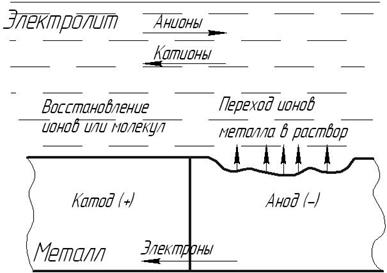
Рис. 2.23. Схема работы коррозионного элемента
Внутренние и внешние факторы находятся в неразрывной связи и совместно определяют показатель интенсивности процесса – электродный потенциал, который для любого изолированного i–го участка поверхности может быть представлен в виде функционала [15]
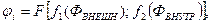
где 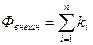
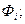
 – функциональные зависимости, характеризующие суммарное влияние на электродный потенциал соответственно внешних и внутренних факторов.
– функциональные зависимости, характеризующие суммарное влияние на электродный потенциал соответственно внешних и внутренних факторов.
В основе электрохимической теории коррозии лежит тесная связь между химическими и электрическими явлениями. Коррозия металлов во влажной атмосфере и водных средах протекает по электрохимическому механизму, когда на поверхности металла идет реакция, аналогичная реакции в гальваническом элементе. При этом образуются коррозионные пары, на поверхности корродирующего металла формируются анодные и катодные участки. Разделение металла на анодные и катодные участки обусловлено электрохимической неоднородностью поверхности, связанной с различием физического состояния и структуры поверхности. Причинами этого могут быть структурная неоднородность металла (зерно и граница зерна, макро – и микровключения), различная деформация, загрязнение поверхности, несплошность и неоднородность защитных пленок, наличие оксидных пленок. Анодными становятся более деформированные, напряженные или нагретые участки.
Анодная и катодная реакции протекают на поверхности одновременно и могут быть частично или полностью разделены в пространстве (рис. 2.25). Возникшая по тем или иным причинам электрохимическая неоднородность приводит к разделению поверхности на катодные и анодные участки. Наряду с такими факторами, как структурная и химическая неоднородность, к этому может приводить и напряженное состояние, которое облегчает выход на поверхность металла дислокаций, разрушающих оксидные пленки, увеличивает степень электрохимической гетерогенности, интенсифицирует анодные процессы и ускоряет разрушение соединения.
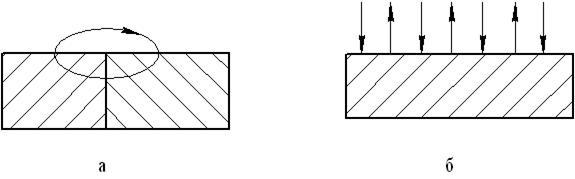
Рис. 2.25. Коррозионный элемент: а – анодная и катодная поверхности различимы; б – анодная и катодная поверхности неразличимы
Короткозамкнутый элемент, схематически представленный на рис. 2.26, называется в дальнейшем коррозионным элементом.
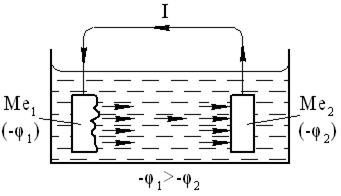
Рис. 2.26. Схема короткозамкнутого коррозионного элемента: Ме 1 – анод; Ме 2 – катод; I – ток, определяющий коррозию анода
Существуют два основных типа коррозионных элементов (см. рис. 2.25):
1) коррозионные элементы с разделенными анодными и катодными поверхностями, например, пара алюминиевый сплав – медный сплав, где алюминий является анодом, а медь катодом;
2) коррозионные элементы с неразделенными анодными и катодными поверхностями; вся поверхность металла является и анодом, и катодом; в этом случае поверхности анодов и катодов можно представить небольшими и многочисленными и, кроме того, способными меняться местами в короткие интервалы времени.
Процессы окисления и восстановления происходят зачастую в одном и том же месте поверхности, чередуясь во времени. Внешней цепью в таких системах служит сам металл. Точки, где реализуются элементарные акты окисления (ионизация металла) и восстановления (ассимиляция электронов деполяризатором – растворенным в электролите кислородом или ионом водорода), мигрируют по поверхности, меняясь местами случайным образом. Под влиянием различных причин они могут быть фиксированы на поверхности, вызывая местную коррозию. Это особенно свойственно поликристаллическим металлическим материалам.
Электрохимическая коррозия металлов в настоящее время уже не рассматривается как результат работы гальванического элемента, поскольку при коррозии чистых металлов и технических сплавов пространственного разделения электродов в большинстве случаев не существует. Однако пространственное разделение анодной и катодной реакции оказывается энергетически более выгодным, так как эти реакции могут локализоваться на тех участках, где их протекание более облегчено.
Размер и расположение катодных и анодных участков зависят от многих факторов (неоднородности металла, аэрации, концентрации ионов и солей). Особенно опасно возникновение небольших анодных участков на поверхности (в результате различия в свойствах металла и границ зерен, других фаз, напряжений в металле и т. д.). В ходе коррозии химический состав раствора вблизи металлической поверхности подвергается непрерывным изменениям, возникают вторичные реакции; вблизи участков поверхности, где преобладают анодные процессы, электролит подкисляется, вблизи катодных участков – подщелачивается.
Если соединить проводником металлы, погруженные в раствор и имеющие разные потенциалы по отношению к электролиту (см. рис. 3.4), то в результате появления электродвижущей силы в образующемся элементе по проводнику потечет электрический ток. В электролите ток будет направлен от металла, имеющего более отрицательный потенциал 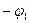 , к металлу, имеющему более положительный потенциал
, к металлу, имеющему более положительный потенциал 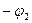 , т.е. в этой цепи металл, имеющий более отрицательный потенциал, является анодом, а сопряженный с ним металл – катодом. Наблюдаемая скорость анодного растворения металла, в общем случае, представляет собой разность скоростей анодного и катодного процессов. Последним в данном случае является восстановление
, т.е. в этой цепи металл, имеющий более отрицательный потенциал, является анодом, а сопряженный с ним металл – катодом. Наблюдаемая скорость анодного растворения металла, в общем случае, представляет собой разность скоростей анодного и катодного процессов. Последним в данном случае является восстановление
(обратное осаждение) ионов металла, перешедших в раствор.
В общем виде скорость протекания коррозионного процесса 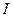 определяется как
определяется как
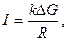
где 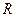 – кинетическое торможение (сопротивление) протеканию коррозионного процесса;
– кинетическое торможение (сопротивление) протеканию коррозионного процесса; 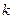 – коэффициент.
– коэффициент.
Химическое состояние систем (поверхность металла – водная среда) характеризуется термодинамическими параметрами состояния, которые дают наиболее общую характеристику системы. Однако только термодинамические факторы не определяют однозначно скорость реального коррозионного процесса 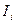 , которая зависит от кинетических и структурных факторов:
, которая зависит от кинетических и структурных факторов:
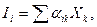
где величина 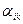 имеет обобщенный смысл и отражает, в частности, роль диффузионной и химической кинетики, а величина
имеет обобщенный смысл и отражает, в частности, роль диффузионной и химической кинетики, а величина 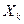 характеризует термодинамический стимул процесса разрушения. Механизм коррозии определяется термодинамическими и кинетическими факторами. Термодинамические факторы определяют склонность металла к коррозии, а кинетические – скорость ее протекания. Первопричиной коррозии металлов является термодинамическая неустойчивость металла в данной среде.
характеризует термодинамический стимул процесса разрушения. Механизм коррозии определяется термодинамическими и кинетическими факторами. Термодинамические факторы определяют склонность металла к коррозии, а кинетические – скорость ее протекания. Первопричиной коррозии металлов является термодинамическая неустойчивость металла в данной среде.
Кинетические закономерности электрохимических процессов, в сущности, сводятся к функциональному уравнению вида
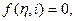
посредством которого две переменные величины – скорость процесса, мерой которой является плотность тока 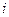 , и отклонение фактического электродного потенциала от стационарного (поляризация) связываются между собой.
, и отклонение фактического электродного потенциала от стационарного (поляризация) связываются между собой.
Для осуществления анодного и катодного процессов необходима затрата энергии. В короткозамкнутом коррозионном элементе эта энергия доставляется электродвижущей силой, которая расходуется при прохождении тока на преодоление омического сопротивления электролита и на осуществление процессов на аноде и катоде, т.е. прохождение тока с анода в электролит и из электролита на катод связано с преодолением некоторых сопротивлений, обусловленных процессами на обоих электродах. Равновесие на границе раздела проводящих фаз является динамическим: ежесекундно определенное количество зарядов переходит границу в одну сторону и такое же количество – в другую. Таким образом, хотя общий ток равен нулю, через границу постоянно проходят парциальные токи в обоих направлениях и наблюдается постоянный обмен заряженными частицами между обеими фазами.
Возникновение и развитие коррозионного разрушения 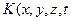 ) определяется соотношением энергетического фактора
) определяется соотношением энергетического фактора 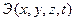 (воздействия) и физико-химических факторов, характеризующих сопротивляемость (реакцию) металла
(воздействия) и физико-химических факторов, характеризующих сопротивляемость (реакцию) металла 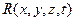 , то есть способность противостоять коррозионным и силовым нагрузкам. Условие разрушения в общем виде
, то есть способность противостоять коррозионным и силовым нагрузкам. Условие разрушения в общем виде
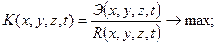
здесь x, y, z – координаты относительно центра шва; t – время.
Значительная часть паяных соединений и узлов подвержена воздействию агрессивных сред, как при эксплуатации, так и в процессе химико-технологической обработки. Однако сопротивляемость соединений коррозионному разрушению, особенно в условиях напряженного состояния, изучена мало.
ПС обладают высокой структурно-химической макро– и микронеоднородностью металла, обусловленной разными свойствами припоя и паяемого металла, и поэтому являются системами с повышенной термодинамической неустойчивостью. Это проявляется в характере распределения микротвердости и электродного потенциала.
Геометрическая неоднородность, возникающая в ПС, связана с наличием как внешних (непропай, неспай), так и внутренних дефектов (поры, флюсовые включения и др.), а также конструктивных концентраторов напряжений, зависящих от типа соединения – встык, внахлестку и др.
Эти основные виды неоднородности определяют механическую, физическую и электрохимическую неоднородности, которые являются интегральными характеристиками свойств соединения и влияют на показатели коррозионной и коррозионно – механической стойкости (долговечность, «пороговые напряжения», скорость коррозии и др.).
В условиях напряженного состояния разрушению могут подвергаться не только анодные, но и катодные участки соединения, которыми обычно являются паяные швы. Это связано с тем, что в условиях напряженного состояния в катодном паяном шве могут развиваться собственные анодные участки, появление которых может быть обусловлено порами, непропаями, чисто механическими повреждениями в виде рисок или химической гетерогенностью паяного шва.
Согласно концептуальной модели О.И. Стеклова [16] сопротивление
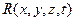 металлических конструкций разрушению и обратная величина
металлических конструкций разрушению и обратная величина
(склонность к разрушению) определяются тремя основными условиями: свойствами материала М; напряженно – деформированным состоянием Н и воздействием среды С, т. е.
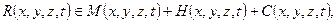
которые в течение «жизненного цикла» конструкции изменяются во времени t.
Свойства металла определяются его исходными параметрами МИ, их изменениям под влиянием технологической обработки ∆ М Т в процессе изготовления конструкции и при эксплуатации ∆ М Э. Таким образом,
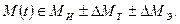
Исходные свойства материала М И зависят от химического состава материала, его структурного и фазового состава, содержания и распределения примесей, а также от технологической наследственности. Фактор М И определяет исходную сопротивляемость материала воздействию среды и нагрузки в данных условиях.
Второй и третий факторы определяются степенью изменения сопротивляемости  .
.
Технологические операции, используемые в процессе изготовления конструкции (например, пайка), снижают исходные свойства металла в связи с появлением дополнительной гетерогенности системы «металл – среда», обусловленной появлением различного вида неоднородностей (макро – и микрохимической, структурной, упругопластического состояния, геометрической, физической, электрохимической и др.).
Значительное изменение свойств материала 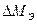 происходит под действием эксплуатационной среды.
происходит под действием эксплуатационной среды.
Напряженно – деформированное состояние конструкции определяется расчетными нагрузками 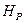 , технологическими напряжениями
, технологическими напряжениями 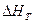 (сборочно – монтажными, деформационными, паяльными и др.), их отклонениями при эксплуатации
(сборочно – монтажными, деформационными, паяльными и др.), их отклонениями при эксплуатации 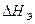 :
:
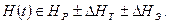
Напряженное состояние характеризуется значением, знаком, жесткостью схемы, концентрацией, градиентом, цикличностью упругих и пластических деформаций и напряжений первого и второго рода (σ I, σ II), запасом и концентрацией потенциальной энергии (WI, WII) элементов конструкции и всей конструкции в целом.
Влияние эксплуатационной среды С (x, y, z, t) определяется ее исходными свойствами С И (химическим составом, концентрацией активных ионов, рН, наличием примесей), характеризующими как технологические среды и транспортируемые продукты, так и влиянием внешних факторов (условиями контактирования среды с материалом, температурой, давлением, скоростью движения среды, наличием твердых частиц и т.д.), качеством защиты, характером эксплуатационных изменений (С Э), степенью нарушений проектных заданий, технологическими факторами С Т, т.е.
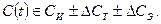
В соответствии с предлагаемым О.И. Стекловым подходом к рассмотрению явлений коррозионного разрушения материалов следует оценивать поведение паяных узлов в агрессивных средах.
Особенности коррозионного процесса паяных соединений определяются условиями их получения. В отличие от сварки плавлением пайку осуществляют в области температур ниже температуры плавления основного металла. Металл паяного шва по своим физико-химическим свойствам резко отличается от паяемого металла. В связи с этим возникает ряд специфических коррозионных процессов, присущих этому виду соединения.
К паяным соединениям полностью применима информация, которая получена при изучении коррозионных процессов в системах из разнородных материалов, находящихся в контакте. В коррозионных средах с низкой электропроводностью паяные соединения являются не полностью заполяризованными системами. Например, в 0,005 н. растворе NaCl в соединении латуни с алюминиевым сплавом АМц, паяном через медный подслой оловянно – свинцовым припоем регистрируется четкое распределение потенциалов между элементами [17]. Из сравнения значений стационарных потенциалов элементов паяного соединения (табл.) следует, что сплав АМц в данном случае является анодом. Медь, припой и латунь – катоды. На границе контакта с медью потенциал сплава АМц имеет значение более положительное, чем потенциал нарушения пассивного состояния сплава. В данном соединении разрушению подвергается граница этого контакта.
Таблица 1.
| Элемент паяного соединения | Потенциал, мВ | Элемент паяного соединения | Потенциал, мВ |
| АМц Cu | - 310 + 270 | ПОС 40 Л 62 | - 165 + 65 |
В реальных условиях коррозии паяные соединения представляют собой короткозамкнутые пары, являются сложной многоэлектродной гетерогенной электрохимической системой, электродами которой являются основной металл, паяный шов, переходные зоны (диффузионная зона, зона термического влияния). В зависимости от соединяемых материалов (однородные, разнородные), припоев, технологии пайки возникают разные электрохимические системы: бинарные (шов – основной металл); трехэлектродные (шов – переходная зона – основной металл); пятиэлектродные (основной металл одного структурного класса – переходная зона – шов переходная зона – основной металл другого класса). В высокоэлектропроводных средах паяные соединения следует рассматривать как полностью заполяризованную многоэлектродную систему, электрохимическая гетерогенность которой проявляется в различной плотности анодного тока на элементах паяного соединения, что определяется величиной его стационарного потенциала при коррозии. В этом случае поверхность паяного соединения следует характеризовать семейством анодных поляризационных кривых, сдвинутых одна относительно другой (рис. 2.27) [17].
Результаты исследований (рис. 2.28) показывают, что при приближении к границе основной металл-шов скорость коррозии возрастает и достигает максимального значения в зоне термического влияния [18].
С увеличением площади катода (толщина паяного шва а Ш) пропорционально увеличивается площадь анода (основного металла), на котором ускоряются коррозионные процессы.
Коррозионную стойкость такой системы трудно предсказать, так как полярность электродов и скорость их коррозии определяется многими факторами.
Наличие макроэлектрохимической гетерогенности (паяный шов – основной металл) приводит к образованию стабильных во времени коррозионных пар и протеканию ярко выраженной местной или контактной коррозии.
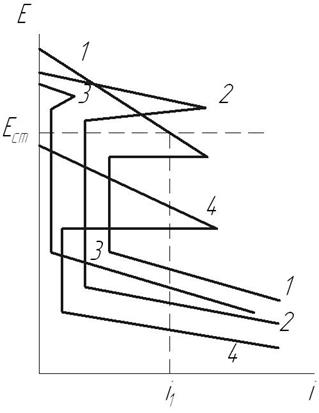
Рис. 2.27.Дифференциальные анодные поляризационные кривые элементов паяного соединения: 1 – диффузионная зона; 2 – ЗТВ; 3 – основной металл; 4 – паяный шов (Е ст – стационарный потенциал паяного соединения, i - скорость коррозии)
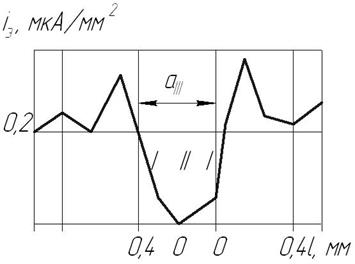
Рис. 2.28. График распределения плотности тока коррозионного процесса по сечению паяного соединения сталь Ст3 – Л63 в 3% - ном растворе NaCl (1 – основной металл, II – паяный шов; аШ – толщина шва).
При этом возможны различные соотношения между электродными потенциалами характерных зон ПС (шов, диффузионная зона и основной металл) и, следовательно, неодинаковая стойкость к коррозионному разрушению.
В процессе коррозии паяного соединения значение его стационарного потенциала устанавливается в результате самополяризации элементов соединения, его величина будет зависеть от окислительно - восстановительного потенциала раствора, перенапряжения катодного процесса и площади электродов паяного соединения (рис. 2.29) [17].
При воздействии среды на такое разнородное соединение скорость коррозионного процесса значительно изменяется. У металла с более отрицательным электродным потенциалом (анод) она увеличивается, а у металла с более положительным потенциалом (катод) уменьшается по сравнению со скоростью коррозии их в отсутствии контакта. Паяный шов, как правило, отличается от паяемого металла по величине электродного потенциала. Опасно, когда анодом является паяный шов или диффузионная зона. Вследствие их малой площади по сравнению с основным металлом повышенная плотность коррозионного тока приводит к большой скорости растворения.
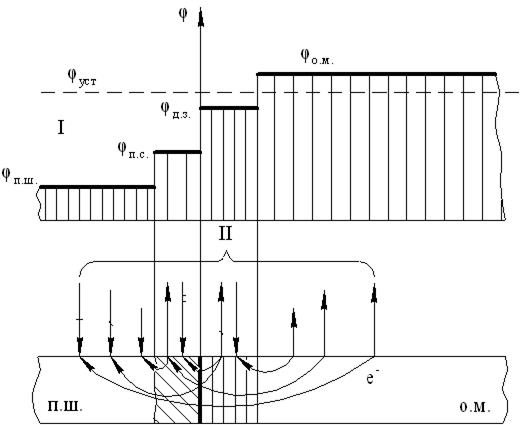
Рис. 2.29. Характерные схемы распределения электродных потенциалов и коррозии паяного соединения: I – схема распределения начальных макропотенциалов в паяном соединении φ п.ш., φ п.с., φ д.з., φ о.м. – электродный потенциал соответственно паяного шва, прикристаллизованного слоя, диффузионной зоны, основного металла; φ уст – стационарный потенциал заполяризовавшейся системы паяный шов – основной металл; II – принципиальная схема макроэлектрохимической коррозии (макропары: зона сплавления – прикристаллизованный слой – диффузионная зона – основной металл); п.ш. – паяный шов; о.м. – основной металл.
Микроэлектрохимическая гетерогенность (неоднородность структуры) приводит к возникновению межкристаллитной, структурно-избирательной или ножевой коррозии в основном металле, паяном шве или на границе металл – паяный шов.
В паяной конструкции нельзя полностью избавиться от эффектов, связанных с контактной коррозией, если даже конструкция изготовлена из однородных материалов.
В результате протекания ряда явлений (растворение жидким припоем паяемого металла, обеднение припоя компонентами, переходящими в твердый раствор или образующими интерметаллические соединения с основным металлом, испарение летучих компонентов и др.) химический состав кристаллизационных зон не совпадает с составом исходного припоя, поэтому нельзя руководствоваться только исходными свойствами припоя при их выборе, без изучения коррозионных характеристик полученного соединения.
Фактором, который может играть важную роль, является величина остаточных напряжений по границе спая. Это, без сомнения, увеличивает скорость коррозии, но не может быть единственной причиной разрушения. Однако поведение ПС при воздействии агрессивных сред в условиях напряженного состояния недостаточно изучено, недостаточно известны причины повышенной чувствительности границы сплавления к воздействию среды, неясен механизм проникновения среды к границе раздела в соединении.
В результате локальной пластической деформации, приводящей к разрушению защитных пленок, может образовываться чистая (ювенильная) поверхность, на которой при реакции с окружающей средой происходят локальное анодное растворение, нередко с образованием хрупкой фазы (например, оксида), а также поверхностная адсорбция.
Внутренние трещины, которые под влиянием водорода (при воздействии H2S и кислых сред) растут до критических размеров, могут распространяться дальше под действием внешних напряжений.
В зависимости от величины стационарного потенциала элементы паяного соединения могут находиться в различном состоянии. Например, при потенциале Е ст (см. рис. 2.27) происходит активное растворение диффузионной зоны паяного соединения, паяный шов выполняет функции катода; остальные элементы соединения находятся в пассивном состоянии.
Это позволяет определить скорость коррозии каждого элемента паяного соединения как абсциссу точек пересечения прямой, соответствующей значению стационарного потенциала соединения в данной среде с парциальными анодными поляризационными кривыми, полученными в этих условиях.
Исходя из общих представлений о бинарных системах, сформулированы [18] общие требования, которые необходимо выполнять для уменьшения скорости коррозии ПС при воздействии агрессивных сред:
- припой должен быть катодом по отношению к соединяемой детали;
- в случаях, когда требуется применение припоя, анодного по отношению к соединяемой детали, необходимо, чтобы его поверхность не была слишком мала;
- необходимо применять флюс, не вызывающий коррозию.
Контрольные вопросы
-Особенности коррозионных процессов металлических материалов?
- Основные реакции процесса электрохимической коррозии?
- Условия самопроизвольного протекания коррозионного процесса?
- Схема работы коррозионного элемента?
- Причины образования анодных и катодных участков поверхности?
- Условия коррозионного разрушения паяных соединений?
- Характерные схемы коррозии паяных соединений?
- Общие требования, позволяющие уменьшить скорость коррозии паяного соединения?
3.Вероятностная оценка прочности паяных соединений и узлов
В действующих нормах оценки прочности конструкций остается неразрешенным противоречие между детерминизмом расчетного аппарата и статистическо-вероятностной природой расчетных параметров.
Способы расчета и проектирования, основанные на применении коэффициентов безопасности или запаса прочности, не позволяют судить о вероятности отказа элемента, так как при одном и том же коэффициенте безопасности вероятность отказа может изменяться в весьма широких пределах. Поэтому обычный детерминистский подход к проектированию не всегда является удовлетворительным с точки зрения анализа надежности конструкции.
Расчет надежности является логическим развитием метода расчета по предельным состояниям и обеспечивает лучшее приближение статистических расчетов к действительным условиям работы конструкций (рис. 3.1).
Получить достоверные результаты при выполнении детерминированных расчетов практически невозможно, так как нагрузка, прочность и другие расчетные параметры конструкций, в том числе и паяных, являются случайными параметрами, находящимися под воздействием различных случайных изменчивых величин. Существующие в действующих нормах и правилах решения используют аппарат случайных процессов в весьма ограниченных пределах, практически только в тех случаях, когда статистически- вероятностные решения оказываются единственно возможными.
Создание конструкций ответственного назначения требует более полного объема информации об условиях напряженности и прочности деталей, что, по мнению А.И. Биргера [20], предопределяет необходимость применения статистических методов оценки прочности и долговечности конструкций.
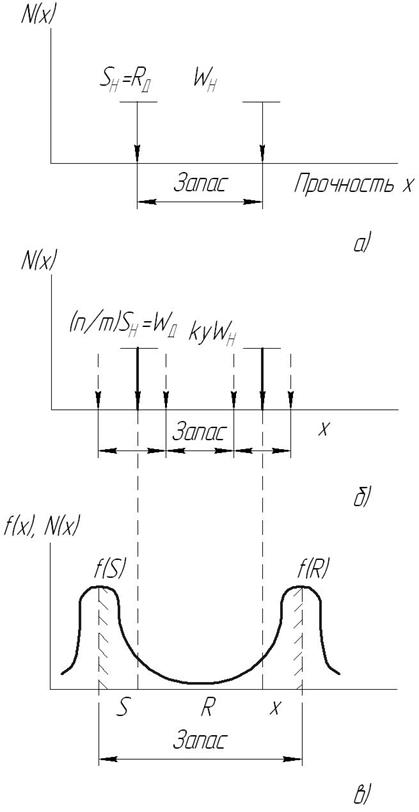
Рис. 3.1. Схема оценки запаса прочности и несущей способности (прочности) W сварных соединений [19]: а - детерминистическая – по допускаемым напряжениям WД; б - полувероятностная –по предельным состояниям; в - вероятностная – по вероятности разрушения; WH и SH – нормативные значения прочности и нагрузки; WД – допускаемые значения; N(x) или f(x) – относительные частоты появления или плотность вероятности
Как подчеркивал С.В. Серенсен, статистические методы углубляют и делают более объективными инженерные расчеты на усталость, позволяя в дальнейшем перейти к расчетам по критериям эксплуатационной надежности с учетом как технических, так и экономических факторов. Оценивая общие перспективы будущего развития методов расчета деталей машин, Д.Н. Решетов прогнозирует, что расчетные характеристики будут задаваться не пределами, а средней величиной и дисперсией или законом распределения. Статистические теории являются практически единственной основой для расчетного определения предельного состояния реальных деталей и элементов конструкций.
Запас прочности определяется следующими случайными событиями.
1. Недостаточным соответствием расчетной схемы фактическому состоянию нагружения конструкции, реальная конструкция в процессе расчета заменяется расчетной схемой. Например, корпус сосуда можно представить как балку (контур поперечного сечения не деформируется) или как оболочку (контур поперечного сечения деформируется); оболочку можно представить гладкой или каркасированной и т.д.
2. Каждое предприятие, производящее листовой материал или другие полуфабрикаты, выпускает их с определенными допусками на размеры, причем стандарт допускает отклонения толщины лишь в меньшую сторону. В расчетах при этом учитывают либо номинальное, либо гарантированное минимальное значение, реальная же конструкция изготавливается из полуфабрикатов, у которых геометрические размеры имеют случайный разброс; учесть это несоответствие сложно.
3. Ограничением номенклатуры поставляемого на завод-изготовитель сортамента (полуфабрикатов). Обычно завод-изготовитель требуемые профили переменного сечения изготавливает самостоятельно из полуфабрикатов. При этом площади поперечных сечений полученных узлов, их моменты инерции оказываются отличными от расчетных, т.е. выполнить конструкцию равнопрочной по всем сечениям и узлам очень трудно.
4. Невозможностью при экспериментальной проверке прочности конструкции полностью воспроизвести характер нагружения элементов, а также условия работы всей конструкции.
5. Другими обстоятельствами технологического, конструкторского, расчетного порядков, не позволяющие получить точного соответствия между проектной и реальной конструкцией.
Пусть два однотипных элемента, прочность которых характеризуется линиями 1 и 2 (рис. 3.2), подвергаются действию случайной нагрузки 3. До тех пор, пока прочностные характеристики элемента 1 стабильны и различные повреждающие факторы (температура, коррозия и т.п.) еще не привели к их снижению (горизонтальный участок линии 1), разрушений не происходит.
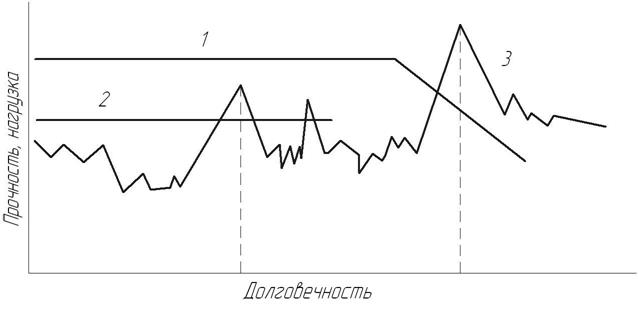
Рис. 3.2. Долговечность элементов при разном уровне прочности
Под действием упомянутых факторов прочность элемента с течением времени снижается (наклонный участок линии 1) и в момент времени 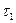 происходит повреждение или разрушение элемента. Для элемента 2, обладающего более низкой прочностью, разрушение может произойти в момент
происходит повреждение или разрушение элемента. Для элемента 2, обладающего более низкой прочностью, разрушение может произойти в момент 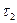 , то есть еще на горизонтальном участке линии 2. Таким образом, фактическая долговечность двух однотипных деталей оказалась различной, что указывает на ее случайный характер. Это обусловливает необходимость, наряду с оценкой долговечности в детерминированной постановке, дополнять ее использованием вероятностных характеристик, которые более достоверно отображают фактическую природу прочности и долговечности конструкций.
, то есть еще на горизонтальном участке линии 2. Таким образом, фактическая долговечность двух однотипных деталей оказалась различной, что указывает на ее случайный характер. Это обусловливает необходимость, наряду с оценкой долговечности в детерминированной постановке, дополнять ее использованием вероятностных характеристик, которые более достоверно отображают фактическую природу прочности и долговечности конструкций.
На ранних стадиях проектирования, когда отсутствуют характеристики распределения геометрических и механических параметров элементов конструкции, можно применить приближенный метод расчета по допускам на величины.
Проблема оценки и контроля надежности паяных конструкций и узлов
обусловлена главным образом следующими причинами:
1. Ростом сложности современных паяных конструкций, включающих большое число отдельных соединений и узлов.
2. Интенсивностью режимов эксплуатации конструкций и отдельных узлов при высоких температурах, давлениях, скоростях, агрессивных средах и др.
3. Сложностью условий, в которых эксплуатируется паяная конструкция.
4. Возросшими требованиями к качеству работы конструкций: высокие точность, эффективность и т.п.
5. Повышением ответственности функций, выполняемых конструкцией,
высокой технической и экономической ценой разрушения.
Общая теория надежности позволяет:
- определить общие подходы и принципы оценки надежности узлов и конструкций вместо частных, иногда далеко не полных и кустарных подходов, которые разви
Дата добавления: 2017-05-02; просмотров: 3703;











