Расплавленный металл
К металлам относятся элементы, атомы которых имеют небольшое число сравнительно легко отделяемых валентных электронов. В твёрдых металлах между атомами возникают значительные силы взаимодействия, превращающие атомы в катионы, которые размещаются в узлах кристаллической решетки. Валентные электроны перестают принадлежать каждому атому в отдельности. Непрерывно переходя от одного атома к другому, они осуществляют связь между катионами в кристаллической решетке. Наличием таких свободных электронов объясняются специфические свойства металлов (электропроводность, теплопроводность и др.).
Жидкие металлы, не сильно перегретые выше температуры плавления, имеют примерно такую же электро- и теплопроводность, как кристаллы. Это даёт основание считать, что жидкие металлы, так же как и твёрдые представляют собой системы, состоящие из положительных ионов и свободных электронов. Однако в расплавах дальнейший порядок разрушен.
Чёрные металлы, получаемые в производственных процессах, содержат различные примеси. По форме существования в железе примеси можно разбить на следующие группы:
1. Марганец, хром, никель и др.
К этой группе относятся металлы, у которых атомные радиусы отличаются от атомного радиуса железа не более, чем на 10…15%. Они расположены с железом в одной или смежных группах периодической системы. Эти примеси обладают неограниченной растворимостью в жидком железе и высокой (часто неограниченной) в твёрдом. Они образуют с железом твёрдые растворы замещения, занимая часть узлов кристаллической решетки растворителя, и отдают свои валентные электроны, превращаясь в катионы. Поэтому считают, что в расплаве марганец, хром, никель и подобные им элементы находятся в таком же состоянии, как железо.
2. Углерод, азот, водород.
Атомы этих элементов имеют радиусы (<1 Å) значительно меньше, чем у железа (1,27 Å). При малых концентрациях они образуют с железом твёрдые растворы внедрения, размещаясь в промежутках между его атомами в кристаллической решетке. Рассматриваемые элементы с железом и другими переходными металлами образуют соединения - карбиды, нитрида, гидриды, - называемые фазами внедрения. В отличие от растворов внедрения, в которых сохраняется кристаллическая решетка металла - растворителя, фазы внедрения (соединения) приобретают иное строение.
Элементы данной группы, как в твёрдых растворах, так и в соединениях находятся в металлическом состоянии, о чем, в частности, свидетельствует высокая электропроводность фаз внедрения, такого же порядка, как у соответствующих металлов. Следовательно, и в расплавах углерод, азот и водород находятся, вероятно, в металлическом состоянии.
3. Кремний, фосфор.
Эти элементы неограниченно растворимы в жидком железе, имеют значительную растворимость в твёрдом железе ( до 19% Si, до 2,8 % Р).
При 50 ат. % Si и 33,3 ат. % Р образуются прочные соединения – силицид железа FeSi, и фосфид железа Fe2Р, которые сохраняются и расплаве.
4. Кислород, сера.
Обладают очень малой растворимостью в твердом железе (менее 0,01 % О и менее 0,015 % S). В жидком железе кислород растворяется ограниченно (~0,23 % при 1600 ºС), сера - неограниченно. С железом эти элементы образуют прочные соединения - оксиды и сульфиды. Разница в электроотрицательности у железа и кислорода больше, чем у железа и серы. В кристаллах оксидов преобладает ионная связь, а у сульфидов повышена доля ковалентности. Растворение кислорода и серы в жидким железе тоже сопровождается значительным химическим взаимодействием. Исследования показывают, что в расплаве железа кислород и сера присутствуют в одноатомном состоянии. В расплаве железа молекулы FeO отсутствуют.
ОСНОВЫ ТЕОРИИ РАСТВОРОВ
Растворы
Шлаки и сплавы представляют собой растворы, образование и процессы в которых подчиняются определенным законам. Рассмотрим основы теории растворов, которые относятся как к жидким, так и к твердым растворам.
В металлургических системах часто имеют дело с разбавленными растворами (любой промышленный сплав). Для анализа процессов в таких растворах за стандартное состояние для растворителя (металл – основа сплава) принимают реальное состояние чистого вещества, а в качестве раствора сравнения выбирают идеальный раствор, который подчиняется закону Рауля. Для примеси за стандартное состояние принимают условное состояние чистого вещества, в качестве раствора сравнения выбирают бесконечно разбавленный раствор, который подчиняется закону Генри.
Идеальным (или совершенным) считается раствор, в котором силы взаимодействия между одноименного атомами раствора равны силам взаимодействия разноименных атомов: FAA = FAB = FBB.
В силу этого образование раствора не сопровождается ни выделением, ни поглощением тепла, и объём идеального раствора равен сумме объёмов составляющих: V р-ра = V р-теяь + V раствор. в-ва.
Концентрацию компонентов идеального раствора выражается мольной долей N, которая представляет собой отношение числа молей одного компонента к общему числу молей в растворе. Идеальные растворы подчиняются закону Рауля, согласно которому
в идеальных растворах давление насыщенного пара при постоянной температуре прямо пропорционально концентрации вещества в растворе:
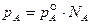 , (53)
, (53)
где 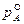 – давление насыщенного пара компонента А, находящегося в чистом виде при той же температуре, что и в растворе.
– давление насыщенного пара компонента А, находящегося в чистом виде при той же температуре, что и в растворе.
Бесконечно разбавленные растворы подчиняются закону Генри:
давление насыщенного пара растворенного вещества А при бесконечно малой концентрации NA→ 0, как в идеальном растворе, прямо пропорционально его концентрации (мольной доле):
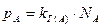 , (53)
, (53)
Отличие между законами Рауля и Генри заключается в значении коэффициента пропорциональности. В уравнении закона Рауля он имеет определенный физический смысл – это действительное давление пара над чистым веществом. В уравнении закона Генри - это эмпирическая величина, найденная из опыта для растворенного вещества в сильно разбавленных реальных растворах.
Свойства реальных растворов, как правило, отклоняются от свойств идеальных. Их образование обычно сопровождается тепловым эффектом и изменением объёма. Это связано с различием сил притяжения между одноименными и разноименными частицами, что приводит к упорядочению.
Давление насыщенного пара какого-либо компонента над неидеальным (реальным) раствором возрастает не пропорционально концентрации, а по сложным зависимостям двух типов.
1. Когда разнородные частицы А и В взаимодействуют между собой сильнее, чем однородные FAB > FAA (FBB), растворенные частицы удерживаются в конденсированной фазе прочнее, чем в идеальных растворах такого же состава. Давление насыщенного пара будет ниже, чем в том случае, если бы раствор был идеальным. Такие отклонения от идеальности (от закона Рауля) называются отрицательными. Образование подобных растворов - процесс экзотермический.
2. Когда силы связи между разнородными частицами в растворе слабее, чем между однородными FAB < FAA (FBB), стремление компонентов покинуть раствор будет выше, чем в идеальном растворе того же состава. Отклонения от идеальности в этом случае называются положительными. Растворение сопровождается поглощением тепла, и компоненты часто обладают ограниченной растворимостью. Одноименные частицы стремятся выделиться в самостоятельные группировки, что при определенных условиях ведет к расслоению систем на разные фазы.
В реальных растворах значения термодинамических потенциалов при данной температуре определяются не только концентрацией рассматриваемого вещества, но и природой и содержанием других компонентов.
Для неидеальных систем вместо аналитической концентрации NA используют активность компонента аА = γА · NA.
Коэффициент активности, как и сама активность, является сложной функцией состава, температуры и т.п. и в суммарном виде характеризует степень связанности частиц в растворе.
Чем прочнее вещество удерживается в смеси, тем меньше коэффициент активности и наоборот.
Дата добавления: 2017-05-02; просмотров: 1500;











