Закон равновесия фаз (правило фаз)
Закон равновесия фаз основывается на втором законе термодинамике и относится к системам, находящимся в равновесии:
сумма числа степеней свободы системы и числа её фаз равна сумме числа независимых компонентов и числа внешних факторов, влияющих на равновесие этой системы
С+Ф=К+n, (46)
где С - число термодинамических степеней свободы системы при равновесии; Ф – число фаз системы; К – число независимых компонентов – наименьшее число компонентов системы, достаточное для количественного выражения состава каждой фазы системы в отдельности; n - число внешних факторов (температура, давление).
Число компонентов К можно найти, если из числа всех присутствующих в системе веществ вычесть число возможных между ними химических реакций.
В металлургических процессах незначительные изменения давления не оказывают ощутимого влияния на свойства металлических сплавов. Для металлургических систем
С= К-Ф+1. (47)
Если система двухвариантна (при наличии одной фазы), то можно изменять в известных пределах температуру и концентрацию, что не вызовет изменения числа или вида фаз системы.
Если система одновариантна (две фазы – идет процесс плавления или кристаллизации двухкомпонентного сплава), то, не изменяя числа или вида фаз, можно изменять произвольно только температуру, или только концентрацию, причем с изменением одного из этих параметров другой параметр не сохраняет прежнего значения, а изменяется в соответствии с первым.
Правило фаз широко применяется при термодинамическом анализе различных систем. Например, по числу степеней свободы можно заранее узнать, какими факторами необходимо задаться для однозначного определения равновесных концентраций компонентов системы.
При условии сохранения равновесия между двумя фазами при фазовом переходе выполняется соотношение (уравнение Клаузиуса-Клапейрона):
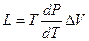 . (48)
. (48)
Для испарения и сублимации оно связывает изменение давления насыщенного пара с температурой ( 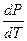 ), изменение объёма (ΔV) и тепловой эффект процесса (L – теплота испарения).
), изменение объёма (ΔV) и тепловой эффект процесса (L – теплота испарения).
Для процессов плавления и полиморфного превращения уравнение связывает изменение температуры перехода с давлением, соответствующее изменения объёма и тепловой эффект.
Так как при плавлении и полиморфном превращении ΔV всегда невелико, то в соответствии с принципом смещения равновесий температура слабо изменяется при изменении давления. В процессах испарения и сублимации ΔV всегда бывает большим и, следовательно, изменение давления сильнее влияет на температуру.
Пример. Соотношение между карбонатом кальция, оксидом кальция и углекислым газом при равновесии определяется реакцией
CaCO3 (тв) = CaO (тв) + СО2 (г).
Число компонентов К = 3-1 = 2. Состав каждой из трех фаз, присутствующих в смеси, можно охарактеризовать, указав количество в них всего лишь двух соединений, например CaO и СО2 . Если рассматриваемая система находится в равновесии, то любому значению температуры соответствует определенное давление углекислого газа (условие химического равновесия). Согласно правилу фаз С= 2-3+2=1. Следовательно, указанные три фазы могут сосуществовать в определенном интервале температур, то есть число степеней свободы равно единице.
ГЕТЕРОГЕННЫЕ МЕТАЛЛУРГИЧЕСКИЕ РЕАКЦИИ
Дата добавления: 2017-05-02; просмотров: 1502;











