Основы процесса физической абсорбции
Газ или определенный газовый компонент при соприкосновении с жидкостью растворяется в ней. Чем больше парциальное давление газового компонента, тем в большем количестве способен он раствориться в жидкости (абсорбенте).
Наряду с растворением газа в жидкости может идти и обратный процесс перехода газа, растворенного в жидкости, в газовую фазу, где он отсутствует или парциальное давление его мало. Выделение растворенного компонента из раствора происходит вследствие снижения его парциального давления в газовой фазе и снижения растворимости его в жидкой фазе.
Таким образом, между газом и жидкостью по истечении некоторого времени всегда устанавливается равновесное состояние.
Для равновесного состояния идеального газа справедлива зависимость, которую называют законом Генри и выражают формулой
р = ψх, (15.1)
где х — концентрация газового компонента в жидкости; р — равновесное парциальное давление этого компонента в газовой смеси, Па; -ψ — коэффициент, зависящий от свойств газа и жидкости и температуры, Па (табл. 15.1).
Таблица 15.1. Значения коэффициента ψ
| Газ | Коэффициент ψ при | ||
| 0 °С | 30 °С | 60 °С | |
| Аммиак | 0,0269 | 0,133 | 0,497 |
| Диоксид серы | 0,145 | 0,962 | 1,68 |
| Диоксид углерода | 30,2 | 80,6 | |
| Кислород |
В соответствии с законом Генри зависимость между концентрацией сорбтива в газовой и жидкой фазе в равновесном состоянии будет выражаться линией ОС (рис. 15.1). Закон Генри справедлив для слабоконцентрированых растворов и нарушается в случае высококонцентрированных растворов, а также при наличии между поглощающей жидкостью и поглощаемым газом химического воздействия.
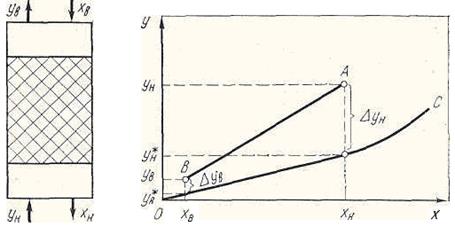
Рис. 15.1. Схема процесса абсорбции в условиях противотока газа и жидкости. Принятые обозначения: ОС — линия равновесия y* = f(x); AB — рабочая линия — прямая, проходящая через точки yи хн и yв хв.
Растворимость газа в жидкости повышается с увеличением парциального давления газового компонента и понижается с увеличением температуры. Растворимость газов в жидкостях различна. Например, при нормальных условиях (р = 101,3 кПа, Т = 0 °С) для хорошо растворимых в воде газов (аммиака, хлористого и фтористого водорода) она измеряется сотнями граммов на 1 кг воды, а для плохорастворимых газов (кислорода, азота, оксида углерода) — десятыми и сотыми долями грамма на 1 кг воды. Хлор и диоксид серы имеют среднюю растворимость.
Физическую абсорбцию водой в чистом виде можно применить только для хорошо растворимых газов (аммиака, хлористого и фтористого водорода). Абсорбция диоксида серы будет нецелесообразна из-за большого расхода воды. Удаление из газов оксида углерода путем промывки водой практически невозможно.
Труднорастворимые компоненты в некоторых случаях можно удалять из газов, промывая их жидкостями, химически реагирующими с поглощаемым компонентом, т.е. применяя хемосорбцию.
Десорбцию осуществляют отгонкой в токе инертного газа, подводом тепла к абсорбенту, снижением давления газа над абсорбентом.
Дата добавления: 2021-07-22; просмотров: 605;











