Реакции второго порядка
Для реакций второго порядка кинетическое уравнение имеет следующий вид:
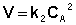 либо
либо 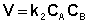
Рассмотрим первый вариант, в этом случае можно переписать уравнение следующим образом:
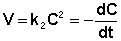
После интегрирования получаем:
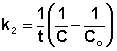
Если начальные концентрации реагирующих веществ Cо,А и Cо,В различны, то константу скорости реакции находят интегрированием уравнения (II.21), в котором CА и CВ – концентрации реагирующих веществ в момент времени t от начала реакции:
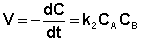
В этом случае для константы скорости получаем выражение
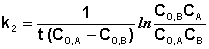
Порядок химической реакции есть формально-кинетическое понятие, физический смысл которого для элементарных (одностадийных) реакций заключается в следующем: порядок реакции равен числу одновременно изменяющихся концентраций. В случае элементарных реакций порядок реакции может быть равен сумме коэффициентов в стехиометрическом уравнении реакции; однако в общем случае порядок реакции определяется только из экспериментальных данных и зависит от условий проведения реакции.
Дата добавления: 2017-05-02; просмотров: 1226;











