Химические свойства алканов
Высокая прочность С-С и С-Н связей в алканах обусловливают их высокую инертность, а низкая полярность и поляризуемость – склонность к гомолитическим реакциям. По этим причинам большинство реакций алканов имеет радикальный характер, а для успеха их протекания требуется внешнее энергетическое воздействие (например, температура, фотолиз, катализ).
Свободнорадикальные реакции алканов
1. Галогенирование.
Алканы очень активно взаимодействуют с фтором, реакция с хлором происходит при освещении и нагревании, взаимодействие с бромом осуществляют при совместном освещении и нагревании. Такие различия обусловлены различной энергетикой реакций галогенирования.
Механизм развития цепей этих реакций можно представить двумя последовательными стадиями.
X + RH HX + R (1)
R + X2 RX + X (2)
При достаточно длинных кинетических цепях стехиометрия брутто-реакции определяется реакциями (1) и (2). Суммирование левых и правых частей уравнений этих реакций приводит к стехиометрическому уравнению.
RH + X2 RX + HX
Фторирование алканов
В случае фторирования реакция протекает самопроизвольно со взрывом из-за высокого теплового эффекта каждой стадии и быстроты их протекания. Инициирование осуществляется посредством бимолекулярной реакции
F2 + RH RF + F + R
эндотермичность которой не превышает 20 кДж/моль. Это обеспечивает умеренное cкорoсти инициирования. При этом высокая экзотермичность реакций (1) и (2) обусловливает близкие к нулю их энергии активации и высокие скорости. В целом это приводит к столь высоким скоростям брутто-реакции и соответственно скоростям тепловыделений, что большая часть выделяющегося тепла идет на разогрев реакционной смеси, приводящего в конечном счете к тепловому взрыву. На практике, чтобы осуществить фторирование с контролируемыми скоростями исходные реагенты разбавляют инертными газами (N2, Ar и др).
Хлорирование алканов
Расщепление молекулы хлора на хлоррадикалы
Cl2 + M M + 2Cl
требует подвода энергии, равной энергии связи Cl-Cl 243 кДж/моль. Поэтому в обычных условиях реакция хлорирования не идет. Более эффективное инициирование можно осуществить путем:
а) Повышения температуры 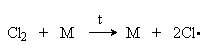
б) Фотооблучения реакционной смеси УФ-светом.
Cl2 + h 2Cl
в) Проведения реакции в присутствии иницииаторов – соединений, легко диссоциирующих на свободные радикалы, которые дают начало цепному процессу.
In2 2In
In + Cl2 InCl + Cl
В качестве инициаторов хлорирования и других свободно радикальных реакций можно использовать органические пероксиды и азосоединения, например бензоилпероксид
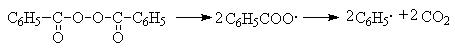
или азобисизобутиронитрил
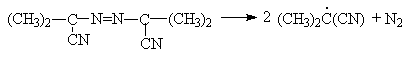
Любой из способов инициирования более эффективно генерирует свободные радикалы, благодаря чему их концентрация становится достаточной, чтобы обеспечить высокие скорости брутто-реакций. Реакции развития цепей (1) и (2) в случае хлорирования метана имеют тепловые эффекты соответственно –4,2 и –109 кДж/моль. Экзотермичность обоих стадий обусловливает низкие энергетические барьеры реакции (1) и (2), что при эффективном инициировании обеспечивает достаточно высокие скорости реакций хлорирования.
Бромирование алканов
Стадия развития цепей (1) для реакции бромирования метана умеренно эндотермична (+67 кДж/моль). Это обусловливает ее высокий энергетический барьер и обратимость. Как следствие длины кинетических цепей низки (от нескольких единиц до 2-3 десятков). Поэтому бромирование метана и других мало реакционноспособных субстратов протекает трудно, более эффективно реакция протекает с реакционноспособными субстратами.
Иодирование алканов
Реакция иодирования алканов оказывается невозможной, так как стадия (1) высоко эндотермична (+138 кДж/моль). Это обусловливает смещение равновесия этой реакции нацело в левую сторону. Наоборот, известно, что йодалканы под действием НJ легко превращаются в алканы и йод.
Наибольший практический интерес имеют реакция хлорирования алканов и их производных.
На самом деле реакция нитрования осложняется деструкцией углеродной цепи с образованием побочных низкомолекулярных нитроалканов и продуктов окисления.
4. Реакции окисления.
Реакции окисления алканов осуществляет в газовой и жидкой фазах. Из газофазных реакций практическое значение имеет окисление метана. Окисление метана имеет последовательно–параллельный характер в соответствии со схемой:
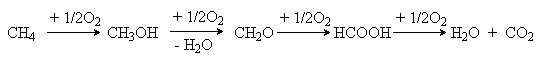
Процесс осуществляют с целью промышленного синтеза метанола и формальдегида. Различают термическое и каталитическое окисление. Первое осуществляют при температурах 500-600о, второе – при 350-450о и катализе AlPO4.
Жидкофазное окисление имеет практическое значение для синтеза высших карбоновых кислот, являющихся сырьем для получения ПАВ:
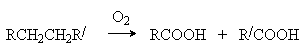
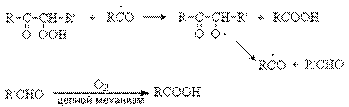
Эти процессы проводят при 120-150оС при инициировании солями Со или Mn, например
Co+3 + RH Co+2 + R + H+
Образующиеся радикалы R дают начало цепному процессу, который представляет собой совокупность цепей свободнорадикальных реакций с вырожденным разветвлением цепей. Ключевую роль в этом процессе играют образование -кетогидропероксида, который вовлекается в реакции деструктивного окисления с образованием карбоновых кислот.
5. Реакции крекинга.
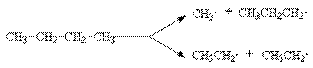
При нагревании выше 500оС алканы подвергаются пиролитическому разложению с образованием сложных смеси продуктов, соотношение которых зависит от температуры и времени реакции. Вся совокупность протекающих при этом реакций называется крекингом. Это типичный свободнорадикальный процесс, инициируемый гомолитическим распадом углерод-углеродных связей исходных алканов. Механизм этого процесса может быть представлен на примере крекинга н-бутана:
Инициирование
Развитие цепей
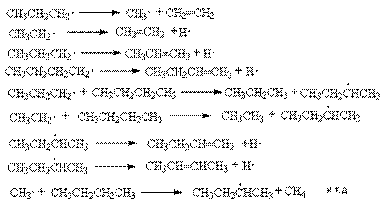
В соответствии с приведенным механизмом основными продуктами крекинга являются алканы и алкены, содержащие меньшее число углеродных атомов, чем исходный алкан.
Если крекинг проводить более глубоко и в жестких условиях, то такой исчерпывающий процесс приводит к преимущественному образованию этилена. Этот процесс называется пиролизом. Он реализуется в широких масштабах для производства этилена.
Другим важным процессом превращения алканов является каталитический крекинг, осуществляемый на алюмосиликатных катализаторах при 400-450оС. Изомеризующее и ароматизирующее действие катализаторов в этом процессе обусловливает образование в значительных количествах алканов с разветвленной структурой и арены. Благодаря этому образующиеся углеводородные фракции имеют высокое октановое число. Поэтому каталитическийкрекинг является основным процессом для промышленного производства высокооктановых бензинов.
Особое место среди процессов крекинга занимает термический крекинг метана, осуществляемый для промышленного синтеза ацетилена.
CH4 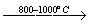 CH2=CH2 + CH CH + H2
CH2=CH2 + CH CH + H2
С целью обеспечения необходимой температуры процесса его совмещают с процессом сжигания метана в едином реакционном объеме.
Дата добавления: 2017-04-05; просмотров: 2764;











