Дифференциальные уравнения термодинамики
Запишем внутреннюю энергию U и энтальпию H системы как функции переменных 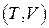 и
и 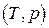 соответственно. Тогда полные дифференциалы этих функций запишутся в виде
соответственно. Тогда полные дифференциалы этих функций запишутся в виде
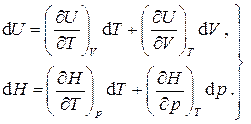 ,
,
где 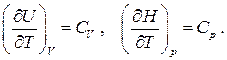
Частные производные при дифференциалах 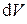 и
и 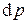 находятся из того факта, что дифференциал энтропии является полным. Имеем из уравнений Гиббса:
находятся из того факта, что дифференциал энтропии является полным. Имеем из уравнений Гиббса:
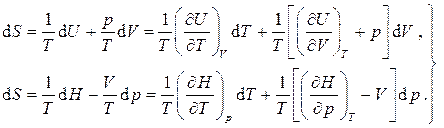
Из равенства перекрестных производных для полного дифференциала получаем
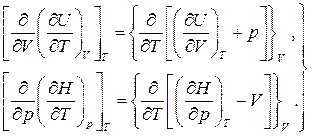
Вычисление частных производных с учетом независимости порядка дифференцирования для непрерывных функций приводит к следующему результату:
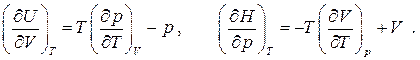
Полные дифференциалы внутренней энергии, энтальпии и энтропии принимают вид
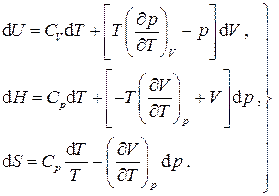
Используя полноту этих дифференциалов, т.е. равенство перекрестных производных, находим зависимость теплоемкостей 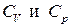 от объема и давления соответственно:
от объема и давления соответственно:
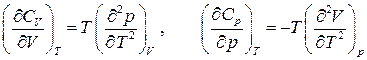 .
.
Функции, частные производные от которых пропорциональны теплоемкостям системы, называются калорическими функциями, а уравнения – калорическими уравнениями состояния. В частности, калорическими функциями являются внутренняя энергия U(T,V) и энтальпия H(T, p).
Дата добавления: 2021-07-22; просмотров: 573;











