Термодинамический процесс
Под процессом в термодинамике понимается любое изменение состояния термодинамической системы, т.е. изменение одного или нескольких парамет
ров состояния. Термодинамический процесс связан с энергообменом системы со средой. В полностью изолированных термодинамических системах возможно протекание процессов выравнивания параметров (процессов релаксации). Согласно так называемому нулевому закону любая изолированная макроскопическая система с течением времени приходит в равновесное состояние, из которого самопроизвольно выйти не может.
Система называется равновесной, если параметры во всех точках одинаковы. Равновесными процессами называются такие, в которых система проходит через непрерывную последовательность равновесных состояний. Равновесные процессы являются также обратимыми –такими, в результате осуществления которых в прямом и обратном направлениях система возвращается в начальное состояние.Классическая термодинамика позволяет рассчитывать только обратимые процессы в многочисленных практических случаях являющиеся хорошим приближением реальных необратимых процессов.
Лекция 3
Внутренняя энергия
Любая термодинамическая система обладает энергией, которая называется внутренней энергией U. Внутренняя энергия тела складывается из всех видов энергий всех частиц, составляющих систему.
Для идеального газа единственной формой энергии частиц может быть только их кинетическая энергия поступательного движения.
1.7. Работа и теплота
Закрытая система может обмениваться со средой энергиями в форме работы и теплоты. Работа это макроскопическая форма обмена энергией между системой и средой. В термодинамике количество работы обозначают буквой L и вычисляют как скалярное произведение силы на перемещение.
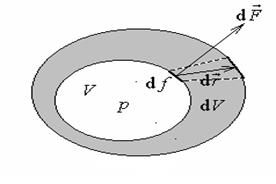 Бесконечно малое количество работы, совершаемое при перемещении элемента поверхности оболочки
Бесконечно малое количество работы, совершаемое при перемещении элемента поверхности оболочки 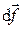 на расстояние
на расстояние 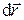 (рис.1.1[U5] ) равно[U6]
(рис.1.1[U5] ) равно[U6] 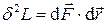 .
.
Рис.1.1. Вычисление работы
Сила, действующая со стороны термодинамической системы на элементарную площадку оболочки, пропорциональна величине этой площадки:
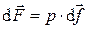 .
.
Интегрирование по всей замкнутой поверхности оболочки дает
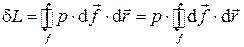 или
или 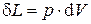 .
.
Количество работы системы при изменении ее объема от V1 до V2 вычисляется интегрированием:
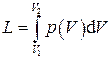 .
.
Отнесенное к единице массы системы количество работы называется удельным количеством работы,
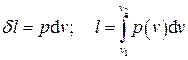 .
.
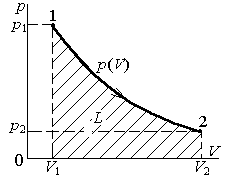
Рис.1.2. Графическое изображение
количества работы.
Количеству работы соответствует площадь под кривой p(v) в системе прямоугольных координат (p – v), что следует из геометрического смысла определенного интеграла (рис.1.2).
Теплота – это микроскопическая форма обмена энергией между системой и средой, приводящая к изменению состояния системы.
Количество теплоты можно определить как величину, пропорциональную изменению температуры системы:
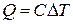 .
.
Величина C (с размерностью Дж/К) называется теплоемкостью.
Теплоемкость
Теплоемкость C может принимать самые различные значения от  в зависимости от процесса подвода или отвода теплоты. В общем случае теплоемкость термодинамической системы C зависит от количества вещества, составляющего систему; физических свойств вещества; температуры; давления и процесса. Теплоемкость, отнесенная к единице количества вещества системы, носит название удельной теплоемкости. В зависимости от способа определения количества вещества используют различные удельные теплоемкости:
в зависимости от процесса подвода или отвода теплоты. В общем случае теплоемкость термодинамической системы C зависит от количества вещества, составляющего систему; физических свойств вещества; температуры; давления и процесса. Теплоемкость, отнесенная к единице количества вещества системы, носит название удельной теплоемкости. В зависимости от способа определения количества вещества используют различные удельные теплоемкости:
массовая теплоемкость, 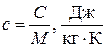 ; объемная теплоемкость
; объемная теплоемкость 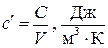 ,
,
мольная теплоемкость 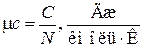 .
.
Эти теплоемкости связаны соотношением
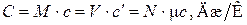 .
.
Количество теплоты, отнесенное к единице массы системы, называется удельным количеством теплоты:
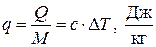 .
.
Рассматриваемые выше теплоемкости представляет собой среднюю теплоемкость в интервале температур ΔT = T2 - T1. При учете зависимости теплoемкости от температуры ее следует определять как отношение бесконечно малого количества теплоты к бесконечно малому изменению температуры:
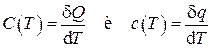 .
.
Определенные таким образом теплоемкости называются истинными при данной температуре, тогда количество теплоты
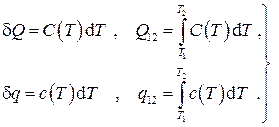
Для удобства в инженерных расчетах выражение для количества теплоты обычно записывается в более простой форме:
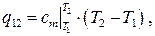
где 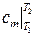 – средняя удельная теплоемкость в интервале температур (
– средняя удельная теплоемкость в интервале температур ( 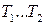 ), определяемая по теореме о среднем как
), определяемая по теореме о среднем как
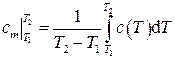 .
.
Дата добавления: 2021-07-22; просмотров: 531;











