Классическая теория теплоемкости
Как известно из статистической физики, энергия ситстемы равнораспределена по степеням свободы (возможным движениям тела) и на каждую степень свободы молекулы приходится одинаковая энергия, равная 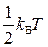 , где
, где 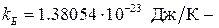 постоянная Больцмана. Тогда внутренняя энергия идеального газа равна
постоянная Больцмана. Тогда внутренняя энергия идеального газа равна
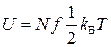 .
.
где f – количество степеней свободы.
Количество молекул N можно вычислить как произведение числа Авогадро NA на число киломолей ν газа, которое определяется делением массы газа M на молярную массу газа μ. Таким образом,
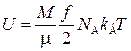 .
.
Учитывая, что 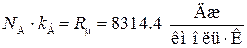 , получим
, получим
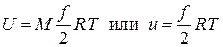 .
.
Теплоемкости при постоянном объеме и при постоянном давлении для идеального газа
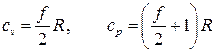 .
.
Формула для cp получена с учетом известной формулы Майера
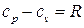 .
.
Отношение теплоемкостей равно
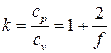 .
.
Вычисленные по этим формулам значения теплоемкостей для различных газов сравнительно хорошо совпадают с экспериментально измеренными их значениями в области комнатных температур. Расхождение с экспериментом становится существенным при повышении температуры.
Главной причиной расхождения теории с экспериментом является то, что при получении выражения для внутренней энергии газов не принимались во внимание квантовые эффекты, учет которых приводит к тому, что число вращательных и колебательных степеней свободы молекул перестает быть постоянной величиной, а зависит от энергии столкновения молекул, т.е., от температуры. Кроме того, с увеличением температуры многоатомные молекулы частично диссоциируют и химический состав газа может заметно измениться.
Лекция 4
Дата добавления: 2021-07-22; просмотров: 585;











