Продукция макрофитов вод и методы ее изучения. Продолжение
По материалам А. И. Гладышева (1977) можно подсчитать, что биомасса корневищ и корней у Potamogeton pectinatus и P. lucens будет в 1,5 раза, у P. perfoliatus — в 1,6, у Caulinia minor (All.) Coss. et Germ. — в 1,2 раза больше, если к ней прибавить вес их отпада. Но такая величина равна годовой продукции подземных органов лишь у однолетника C. minor и близка к ней у P. pectinatus, являющегося, как показал А. Г. Лапиров (1995), вегетативным однолетником, у которого ежегодно отмирает вся вегетативная сфера кроме зимующих небольших размеров клубней. У других же рдестов, имеющих многолетние корневища, показанные величины отпада относятся главным образом к корням и корневищам прошлых лет и лишь в малой степени представляют продукцию текущего года.
К сожалению, имеющихся данных слишком мало, чтобы делать выводы об уровнях чистой годовой продукции подземных органов макрофитов разных экотипов. Ясно лишь, что чаще всего величина подземной биомассы у многолетних водных растений больше этой части продукции. Но на сколько больше — ответить сложно. Для этого необходимо знать, например, продолжительность жизни подземных органов. Нет сомнения, что у разных видов она разная. Так, например, раскопы в зарослях тростника показали, что его живые корневища уходят на глубину более 1 м и в этом метровом слое грунта образуют до 6 горизонтов.
Такая система корневищ, судя по всему, формировалась не один десяток лет. Парциальные кусты Typha latifolia L. s.str. живут 3—6(7) лет, а T. angustifolia s.str. — до 20 лет (Мавродиев, 1999). Корневища этих рогозов также могут быть встречены на большой глубине, но глубже 40 см они единичны и выглядят едва живыми. Активны они (несомненно живы) похоже лишь первые 3—4 года. Такой же срок деятельности у корневищ Butomus umbellatus и, возможно, у Scirpus lacustris, но перестающие функционировать более старые корневища в длительно существующих плотных зарослях этих видов (особенно последнего) долго не разлагаются, внося свои коррективы в подземную биомассу, значительно увеличивая ее.
Глубоко уходят в грунт и, наверное, долго живут корневища Equisetum fluviatile. Несомненно, большим долголетием отличаются корневища Nuphar lutea (L.) Smith и Nymphaea ssp. А вот у рдестов, похоже, подземные побеги сохраняют жизнеспособность года 2—3.
Исходя из этих рассуждений, можно допустить, что в молодых зарослях и краевых участках зрелых сообществ гелофитов их подземная продукция близка или равна весу биомассы корней и корневищ, в средневозрастных сообществах она равна 1/2 биомассы, в старых — 1/4—1/5. Это же соотношение характерно и для кубышки и кувшинки. У многолетних корневищных гидрофитов (кроме кувшинковых) данный коэффициент будет соответственно равен 1,2—0,8—0,5. На практике при расчетах продукции, наверное, лучше пользоваться средними величинами этих значений, то есть, принять соответственно коэффициенты 0,5 и 0,8.
Вышесказанное свидетельствует о явно слабой изученности продукционных проблем в гидроботанике и необходимости уделять им повышенное внимание. В связи с этим остановимся на методах изучения биомассы и продукции водных фитоценозов.
Наиболее оптимальным временем для получения соответствующих данных считается июль и первая половина августа. Действительно, в это время основная часть водных фитоценозов подходит к пику своего сезонного развития, при этом в июле максимально развиты сообщества гидрофитов, а в августе — гелофитов. Но, скажем, жерушниковые, осоковые и хвощевые ценозы к июлю уже проходят свой пик.
Традиционно биомасса водных растений определяется на укосных площадках, которые закладываются в разных частях фитоценозов, либо в пределах площади, выбранной для геоботанического описания сообщества. Распределять площадки надо так, чтобы максимально охватить разнообразие густоты травостоя в нем. Размер укосной площадки может быть различным: в разреженных ценозах — большим, в густых — меньшим, но, как показывает опыт, наиболее подходящей является площадь 0,25 м2 (0,5 X 0,5 м) (Пап- ченков, 1979).
Для разметки площадки можно пользоваться веревкой с колышками, однако более удобны складные разъемные рамки из дерева или легкого металла. И те и другие годятся для исследования сообществ воздушно-водных растений. Для ценозов же придонных макрофитов, не доходящих до поверхности воды, нужны металлические рамки, которые можно положить на дно. В иных ситуациях нужна рамка, плавающая на поверхности воды.
При отборе проб воздушно-водных и придонных растений с площадки у самого дна срезаются все побеги и, если это возможно, выкапываются подземные органы. В случае с укореняющимися гидрофитами, основная масса которых сосредоточена у поверхности или на воде, начинать срезать побеги нужно не со дна, а сверху, отсекая все, что выходит за пределы плавающей на воде рамки, иначе велик риск заметно (иногда в несколько раз) увеличить объем пробы за счет побегов, уходящих далеко за пределы укосной площади.
Каждый укос в отдельности разбирается по видам растений, подсчитывается число побегов (для кувшинковых и стрелолиста — число листьев и цветоносов), с точностью до 10 г взвешивается их сырая масса, измеряется высота наиболее развитых побегов. Отобранные укосы сохраняются для их дальнейшего лабораторного исследования. В лаборатории, после сушки на воздухе, пробы досушиваются в сушильном шкафу при 65°С до постоянного веса и взвешиваются с точностью до 0,1 г. Таким образом определяется воздушно-сухой вес пробы, а по разнице между весом пробы с естественной влажностью и весом в воздушно-сухом состоянии высчитывается процент свободной влаги в растениях.
Далее каждая из проб измельчается, перемешивается и из нее берется навеска, величина которой определяется на аналитических весах с точностью до 0,01 мг. Эти навески высушиваются до постоянного веса при температуре 105°С. По разнице веса до и после сушки определяется содержание связанной влаги. Это позволяет определить общую влажность образцов растений и подсчитать их абсолютно сухую массу. Затем отобранный в качестве навесок материал сжигается в муфельной печи для определения в нем процентного содержания золы и органического вещества.
По содержанию в частях и органах растений органического вещества рассчитывается их энергетическая ценность. При этом можно использовать хорошо зарекомендовавшую себя формулу Э. Т. Хабибуллина (1977): Y = 0,0422 • X, где Y — калорийность сухого вещества в ккал/г, X — процент органического вещества в пробе.
По завершении обработки отобранных в поле проб для каждого вида макрофитов рассчитываются средние величины сырой и абсолютно-сухой массы и ее валовой энергии на 1 м2 сообществ, устанавливаются средние величины фитомассы растений при разных классах их проективного покрытия (до 30%, от 31 до 60%, от 61 до 90% и от 91 до 100%). Результаты подобной работы по сырой биомассе макрофитов рек и водоемов Среднего Поволжья приведены в табл. 1 и 2.
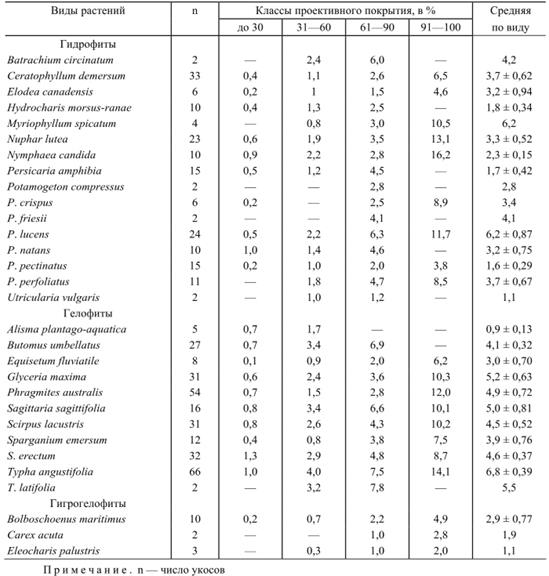
Таблица 1. Сырая надземная биомасса макрофитов рек при различном проективном покрытии, в кг/м2
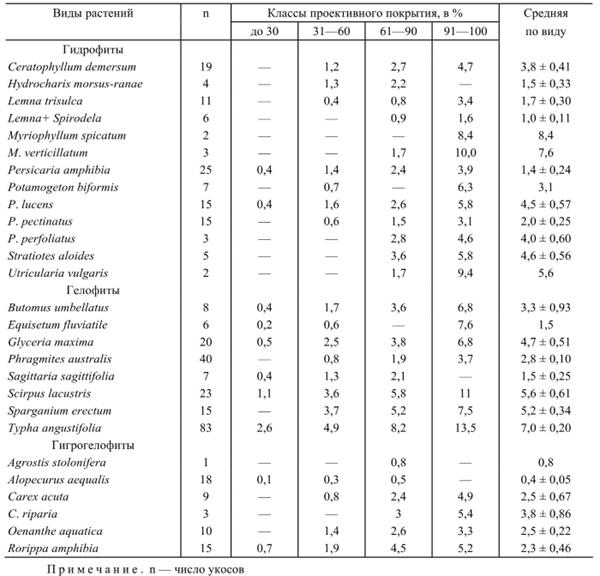
Таблица 2. Сырая надземная биомасса макрофитов водоемов Среднего Поволжья при различном проективном покрытии, в кг/м2
Приведенные табличные данные при наличии геоботанических описаний водной растительности с указанием проективных покрытий видов позволяют рассчитывать биомассу фитоценозов без взятия в них укосов. Еще с большей точностью можно подсчитать биомассу сообществ, если при описании подсчитывалось число побегов вида на учетной площади.
Сложнее изучать сезонную динамику биомассы растений. Наиболее простым методом такой работы является взятие с определенной периодичностью укосов в изучаемых сообществах на протяжении всего сезона вегетации. Однако этот способ не дает удовлетворительных результатов, поскольку сложно найти обширное, достаточно выровненное по видовому составу и густоте травостоя сообщество водных растений, позволяющее брать укосы в нескольких повторностях с периодичностью один раз в 7—10 дней на протяжении 3—4 месяцев.
Отбор же проб один раз в месяц (как это обычно делается) дает лишь весьма приблизительную картину динамики прироста растительной массы фитоценозов. Кроме того, даже при достаточной частоте взятия укосов, позволяющей получить детальную картину изменения фитомассы в сообществе, исследователь не будет получать сведений о динамике опада. Поэтому для продукционных исследований более пригоден метод постоянных учетных площадок, основанный на периодических измерениях высоты всех побегов изучаемого вида в пределах учетной площадки с одновременным отбором рядом с ней модельных побегов (Папченков, 1985).
Работая этим методом, необходимо в начале периода вегетации выбрать достаточно обширную заросль вида, который предполагается изучать, и заложить в ней учетную площадку, по размерам достаточную, чтобы на ней было около 20—30 растений или их побегов. Каждый побег должен быть пронумерован с тем, чтобы можно было получить индивидуальную картину прироста.
Можно пользоваться метками и бирками, но нередко бывает достаточно нанести разметку на грунт (с помощью веточек, веревочек, проволочек и пр.) и вести промеры растений в определенной последовательности, сверяясь с нарисованной в дневнике схемой расположения пронумерованных побегов. Вновь появляющиеся побеги получают свои индивидуальные номера, но это не должны быть номера выпавших, отмерших побегов. Главное, чтобы всякий раз под определенным номером измерялся один и тот же побег.
В дату наблюдений нужно измерить высоту (или длину) каждого наблюдаемого побега, указать число листьев на нем, боковых ветвей, соцветий и прочих счетных частей растения, которые помогут учесть отмершую и опавшую их часть между сегодняшней и предыдущей датой наблюдений. Опаду необходимо уделять повышенное внимание, поскольку без правильной его оценки нельзя правильно рассчитать продукцию.
И так, учетная площадка служит для получения данных по динамике количества побегов и их размерных величин, для перевода которых в весовые показатели необходимо также в каждую дату учета в пределах той же (или идентичной) заросли отобрать пробы модельных растений. Последние отбираются с таким расчетом, чтобы отразить все разнообразие высоты растений на площадке в пределах каких-то классов высот, каждый из которых был бы представлен не менее чем 3—5 побегами. Пробы, для сохранения естественной влажности, укладываются в полиэтиленовые мешки и доставляются в лабораторию.
В лабораторных условиях модельные побеги измеряются с точностью до 1 мм и с точностью до 10 г взвешиваются. Вес побега делится на его длину. Таким образом получается показатель массы побега, приходящийся на единицу его длины, выраженный в мг/см. Показатели усредняются по классам высоты и по ним рассчитывается вес каждого из измеренных побегов в пределах учетной площадки. Суммированием последних получается сырая надземная биомасса растений на площадке с последующим пересчетом ее в фитомассу с 1 м2. Пробы модельных растений высушиваются и обрабатываются далее по приведенной выше схеме, позволяющей получить данные по абсолютно-сухой массе и ее энергетическом эквиваленте.
При замерах наблюдаемых растений учитывается также длина отмерших побегов или их частей. По соответствующим живым аналогам рассчитывается их масса, т.е. масса опада между датами наблюдений, которая суммируется за весь период вегетации.
Таким образом, полученные материалы позволяют рассчитать:
1) общую массу надземных органов наблюдаемых растений на дату учета и опада к этой дате; сумма этих величин дает чистую первичную продукцию за наблюдаемый период (неделю, месяц, период, год);
2) абсолютную скорость накопления растительного вещества в г/м2 в сутки как разницу между величинами фитомассы в данную и предыдущую даты наблюдений, деленную на число суток между ними;
3) относительную скорость накопления растительного вещества в % в сутки как величину абсолютной скорости накопления, деленной на величину фитомассы в дату учета (этот показатель позволяет сравнивать интенсивность прироста массы растений независимо от их размеров и веса);
4) среднюю скорость линейного прироста побегов в см в сутки как разницу средних высот побегов на площадке для соседних дат учета, деленную на число суток между ними.
Преимуществами этого метода является отсутствие необходимости в обширных однородных фитоценозах, возможность применять статистические методы анализа получаемых данных, которые дают разностороннюю характеристику динамики прироста растений в сообществе одновременно по многим показателям; этот метод позволяет проследить индивидуальные особенности линейного прироста и накопления массы растениями изучаемого вида. В качестве недостатков следует отметить большую трудоемкость работы. Однако получаемые результаты явно компенсируют этот недостаток.
Дата добавления: 2023-05-30; просмотров: 714;











