Молярная электрическая проводимость
Молярная электрическая проводимость - эта мера электрической проводимости всех ионов, образующихся при диссоциации 1 моля электролита при расстоянии 1м между параллельными электродами. Для одновалентных электролитов мольная электропроводимость (λ) равна эквивалентной электропроводимости (λэ). 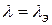
Для 1-2 валентных электролитов 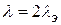 , (CdCI2, H2SO4).
, (CdCI2, H2SO4).
Для 1-3 валентных электролитов 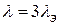 .
.
Между молярной и удельной электрической проводимостью имеется соотношение
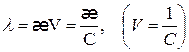 (2.26)
(2.26)
где
λ – молярная электрическая проводимость 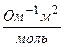 ,
,
V – разведение раствора, м3/моль
с – концентрация, моль/м3.
Если концентрация раствора выражена в моль/л, то
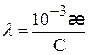 (2.27)
(2.27)
С учетом, что 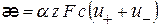 , следует
, следует

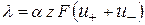 (2.28)
(2.28)
Значение молярной электропроводимости зависит от концентрации электролита
Зависимость молярной электрической проводимости от концентрации для сильных (1) и слабых (2) электролитов.
С увеличением разведения молярная электропроводимость возрастает и в области больших разведений стремится к предельному значению 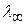 , тогда
, тогда
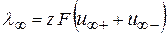 (2.29)
(2.29)
Произведение 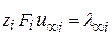 называется предельной электрической проводимостью ионов (
называется предельной электрической проводимостью ионов ( 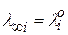 - иногда обозначают так).
- иногда обозначают так).
Тогда
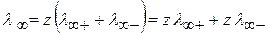 (2.30)
(2.30)
Гипотетический бесконечно разбавленный раствор характеризуется полной диссоциацией электролита и отсутствием электростатических сил.
λ ∞ - это сумма двух независимых слагаемых.
Закон независимого движения ионов Кольрауша:
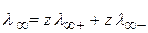 (2.31)
(2.31)
λ ∞ иона=f(Т, природа иона и растворителя)
Соотношение
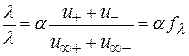 , (2.32)
, (2.32)
где 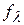 – коэффициент электрической проводимости
– коэффициент электрической проводимости
В разбавленных растворах 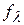 =1, отсюда
=1, отсюда
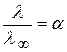 (2.33)
(2.33)
Для сильных электролитов, когда α = 1
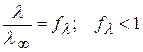 (2.34)
(2.34)
Теория электролитической проводимости растворов Дебая - Онзагера:
Снижение молярной электрической проводимости при переходе от разбавленных растворов к концентрированным растворам связано с уменьшением скорости движения ионов за счет: 1) эффекта электрофоретического торможения, обусловленного электростатическим взаимодействием между ионом и его ионной сферой; 2) эффектом релаксационного торможения (нарушение симметрии иона).
По теории Онзагера 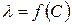 ; для 1,1 – валентного электролита
; для 1,1 – валентного электролита
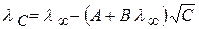 (2.35)
(2.35)
где А и В – константы, полученные с учетом сил релаксационного и электрофоретического торможения.
Дата добавления: 2017-03-12; просмотров: 2448;











