Гидроксония и гидроксида
В водных растворах протон (ион) водорода записывают в виде иона гидроксония – H3O+
H+ + H2O ⇆ H3O+
Ионы H3O+ и гидроксида OH− обладают более высокой молярной электрической проводимостью или подвижностью, чем другие ионы.
Подвижности большинства катионов и анионов лежат в пределах (40-80) 10-4 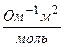 . Значение предельной подвижности, например, иона натрия
. Значение предельной подвижности, например, иона натрия 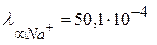
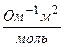 , а иона хлора
, а иона хлора 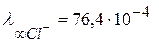
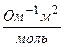 .
.
Значение предельной подвижности иона гидроксония 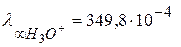
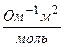 . Это позволяет предполагать, что наряду с миграцией ионам H3O+ и OH- свойственен и другой механизм перемещения в электрическом поле. Аномально высокая подвижность ионов H3O+ и OH- объясняется эстафетным механизмом перемещения ионов, сущность которого заключается в следующем:
. Это позволяет предполагать, что наряду с миграцией ионам H3O+ и OH- свойственен и другой механизм перемещения в электрическом поле. Аномально высокая подвижность ионов H3O+ и OH- объясняется эстафетным механизмом перемещения ионов, сущность которого заключается в следующем:
1. При наложении электрического поля переход протона от H3O+ к молекуле воды повышается в направлении поля. Передвижение протона совершается по цепочке от одной молекулы воды к другой по схеме:
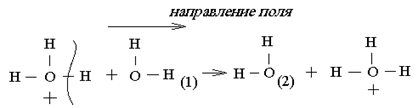
Электричество переносится мигрирующими ионами H3O+ и протонами.
2. Аналогичным образом объясняется подвижность ионов гидроксида. Протон переходит от молекулы воды к иону гидроксида

Так как энергия отрыва протона от молекулы воды больше, чем от иона гидроксония, то вероятность перехода протона от H2O к OH− меньше, чем от Н3O+ к воде. Поэтому 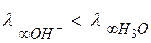
Предельные подвижности некоторых ионов
Р = 1 атм, t = 25°С
| катион | 
| анион | 
|
| H+(H3O+) | 349,8 | OH- | 198,3 |
| Li+ | 38,6 | F- | 55,4 |
| Na+ | 50,1 | CI- | 76,4 |
| K+ | 73,5 | Br- | 78,1 |
| NH4+ | 73,5 | NO3- | 71,4 |
| Fe3+ | HCOO- | 54,6 |
При одном и том же заряде иона с увеличением радиуса иона увеличивается подвижность иона, так как на поверхности иона уменьшается плотность заряда, уменьшается степень его гидратации и эффективный радиус иона.
Дата добавления: 2017-03-12; просмотров: 2826;











