Двойной электрический слой. Возникновение скачков потенциалов на границе раздела фаз.
Рассмотрим систему из двух разнородных фаз. При их соприкосновении система приходит в неравновесное состояние. Согласно второму закону термодинамики система будет стремиться к равновесию. В результате возникает процесс, который сопровождается обменом заряженных частиц между фазами. Такой процесс приводит к тому, что по одну сторону от границы раздела появляется избыток заряда определенного знака, а по другую – его недостаток. Возникает двойной электрический слой (ДЭС). Он напоминает плоский конденсатор с заряженными обкладками. Значит, на границе раздела фаз электрический потенциал φ резко изменяется и наблюдается скачок потенциала ∆φ.
В общем случае могут иметь место следующие скачки потенциалов:
1. поверхностные потенциалы, возникающие на границе раздела вакуум-металл;
2. контактные потенциалы, возникающие на границе раздела двух разных металлов, то есть металл-металл;
3. электродные потенциалы, которые возникают на границе раздела металл – раствор его соли;
4. диффузионный потенциал, возникающий на границе раздела двух разных растворов электролита.
Контактный потенциал возникает на поверхности соприкосновения двух металлов. Он обусловлен разной концентрацией электронов проводимости в рассматриваемых фазах, определяется разностью работ выхода электрона, зависит от температуры и для некоторых пар металлов может достигать нескольких вольт. Абсолютную величину контактного потенциала определить невозможно. Поэтому используют его относительные значения, например контактный потенциал, относительно золота.
Диффузионный потенциал возникает на поверхности раздела двух растворов электролитов с одинаковым растворителем, но отличающиеся по виду электролита или по его концентрации. Такой потенциал возникает за счет различия абсолютных скоростей (подвижностей) ионов электролита. Например, в растворах нитрата серебра AgNO3 подвижность аниона NO3- выше, чем катиона Ag+. Диффузия растворенного вещества происходит в направлении убывания его концентрации. Вследствие этого граница раздела двух растворов AgNO3 заряжается отрицательно со стороны более разбавленного раствора и положительно со стороны раствора с большей концентрацией электролита. Возникает диффузионный ДЭС. По истечении определенного времени, скорости диффузии катионов Ag+ и анионов NO3- выравниваются. На границе раздела возникает равновесие, при котором ток отсутствует, а электролит диффундирует как единое целое в виде AgNO3. Установившуюся между растворами разность потенциалов называют равновесным диффузионным потенциалом φд. Измерить его абсолютное значение невозможно. На практике используют относительное значение.
Так как трудно учесть абсолютное значение диффузионного потенциала, то его стремятся максимально уменьшить. Для этого растворы электролитов разъединяют в пространстве и между ними помещают солевой мостик. Солевой мостик – это U-образная стеклянная трубка, внутри её находится раствор электролита, у которого подвижности ионов одинаковы, например, NaCl, NH4NO3. Электрическая проводимость на границах контакта растворов с солевым мостиком обеспечивается этими ионами, при этом возникают очень малые обратные по знаку диффузионные потенциалы, суммой которых пренебрегают.
Электродный потенциал φM/L возникает на границе металл – раствор электролита. При погружении металлической пластинники, с удаленной оксидной пленкой, в растворе электролита между металлом и раствором возникает ДЭС и скачок потенциала, называемый электродным потенциалом. Основная причина его возникновения – это движение ионов между поверхностью металла и раствором.
Следует отметить для этих явлений важную роль специфической адсорбции ионов и полярных молекул, а также выход электронного газа за границы кристаллической решетки металла.
Рассмотрим образование ДЭС при погружении металлической пластинки в воду или другой полярный растворитель. В этом случае происходят следующие процессы.
1. Катионы, расположенные в узлах кристаллической решетки металла, взаимодействуют на поверхности с полярными молекулами воды, которые ориентированы к катионам своими отрицательными полюсами. При сильном взаимодействии катионы отрываются от поверхности металла и переходят в жидкую фазу
М(т) → Мz+ (р) +Ze- (1).
Системой поглощается энергия, равная энергия связи катиона с кристаллической решеткой ЕМZ+. Образующийся избыток электронов заряжает поверхность металла отрицательно, а выходящие катионы заряжают граничащий с металлом слой воды положительно.
2. Катионы металла гидратируются полярными молекулами воды в объёме жидкой фазы
MZ+ (p) +nH2O → MZ+∙ nH2O (p) (2).
Системой выделяется энергия, равная энергии гидратации Ег. В соответствии с термодинамической системой знаков
ЕМZ+ > 0 и Ег < 0 (3).
Вышерассмотренные процессы 1 и 2 могут протекать одновременно (параллельно друг другу). В этом случае их описывают уравнением
М(т) + nH2O → MZ+∙ nH2O (p) + Ze- (4).
3. Концентрирование гидратированных катионов в граничном с поверхностью металла слое жидкости для компенсирования избыточного поверхностного заряда посредством электростатического взаимодействия. Таким образом, на границе металл – вода возникает обменный ДЭС и соответствующий ему скачок потенциала – электродный потенциал φM/L. С ростом данного потенциала φM/L все быстрее протекают обратные процессы, в результате которых происходит дегидратация ионов металла и их восстановление до атомов в соответствии с уравнением
MZ+∙ nH2O (p) + Ze- → М(т) + nH2O.
При определенном скачке потенциала возникает равновесие, описываемое уравнением
М(т) + nH2O ↔ MZ+∙ nH2O (p) + Ze- (5).
Данному равновесию отвечает равенство скоростей прямого и обратного процессов. В упрощенной форме ему соответствует выражение, в котором нет молекул воды. Такая форма записи рекомендована ИЮПАК и называется уравнением электродного процесса
MZ+ (p) + Ze- ↔ М(т) (6).
Электродный процесс, представленный в такой форме иногда называют потенциалопределяющим процессом.
При погружении металла в раствор его соли, который является электролитом, происходят сходные явления, но равновесие наступает при другом скачке потенциала. Для таких процессов характерно то, что
φM/L = φMZ+/M (7).
Равновесным электродным потенциалом φM/L = φMZ+/M называют скачок потенциала, установившийся между металлом и раствором электролита в условиях равновесия. Металл в растворе собственной соли может заряжаться как отрицательно (Al, Zn, Fe, Ni), так и положительно (Cu, Ag, Au).
Уравнение Нернста.
Уравнение было получено немецким физико-химиком В. Нернстом. Оно связывает электродный потенциал с природой металла, концентрацией его ионов в растворе и абсолютной температурой. Вывод уравнения основан на применении второго начала термодинамики к процессу (6). Для вывода уравнения рассмотрим металл, который представляет собой металлическую пластинку, опущенную в раствор своей соли. Такая система носит название металлический электрод.
Электрическая работа по переносу 1 моль катионов с поверхности металла в раствор или обратно равна произведению суммарного перенесенного заряда Z∙F на разность потенциалов φMZ+/M
Wэл = Z∙F ∙ φMZ+/M (8),
где Z – зарядовое число катиона или число электронов, принимающих участие в процессе; F- постоянная Фарадея, равная 96500 Кл/моль; φMZ+/M – электродный потенциал, В.
Согласно второму закону термодинамики, максимальная работа, совершаемая закрытой системой в изобарно-изотермическом процессе (то есть при Р, Т = const), равна убыли её энергии Гиббса
Wэл = -∆G (9).
Можно получить, используя уравнение изотермы химической реакции, что изменение энергии Гиббса в ходе процесса (6) равно
∆G = -RTlnKa0 + RTln(aM/aMZ+) (10),
где aM – относительная (отнесенная к стандартной) активность металла в кристалле;
aMZ+ - относительная активность ионов металла в растворе.
Из выражений (9) и (10) получаем
Wэл = -∆G = RTlnKa0 - RTln(aM/aMZ+) (11).
Приравнивая выражения для электрической работы (8) и (11), получаем после несложных преобразований уравнение Нернста для металлического электрода
φMZ+/M = (1/Z∙F)∙RTlnKa0 – (1/Z∙F)∙RTln(aM/aMZ+) (12).
Так как К0 – стандартная термодинамическая константа равновесия реакции, то при Т = const она является постоянной величиной. Поэтому для данного электрода первое слагаемое в выражении (12) является постоянной величиной. Его обозначают через
φ0М/MZ+ и называют стандартным электродным потенциалом.
Активность металла аМ в его кристалле для индивидуального вещества является стандартной активностью и равна 1, то есть
аМ = 1 (13).
Тогда получаем выражение для уравнения Нернста, используемое в практических расчетах
φMZ+/M = φ0MZ+/M + (RT/Z∙F)lnaMZ+ (14).
В разбавленных растворах электролитов коэффициенты активности ионов равны их концентрациям. Поэтому уравнение Нернста можно представить в следующем виде, если иcпользовать молярные концентрации ионов СМZ+
φMZ+/M = φ0MZ+/M + (RT/Z∙F)ln СМZ+ (15).
Таким образом, потенциал металлического электрода зависит от природы металла и от условий, в которых находится раствор. Зависимость электродного потенциала от природы характеризуется величиной φ0MZ+/M , которая представляет собой табличное значение стандартного потенциала. Данное значение обычно берут из справочников. Зависимость от температуры раствора и концентрации ионов в растворе определяется вторым слагаемым уравнения Нернста. Как видно из (15), потенциал металлического электрода увеличивается с ростом температуры и концентрации ионов металла в растворе.
Отметим, что иногда встречается выражение уравнения Нернста, имеющего вид
φMZ+/M = φ0MZ+/M + (0,059/Z)lgaMZ+ (16).
Данное уравнение получается при условии Т = 298 К; R = 8,31 Дж/(моль∙К); F = 96500 Кл/моль и замене натурального логарифма на десятичный.
В наиболее общем случае уравнение Нернста записывается для электродного процесса
Ox + Ze- ↔ Red (17),
где Ox – окисленная форма частиц, участвующих в реакции; Red – восстановленная форма частиц, участвующих в реакции. Уравнение Нернста для этого процесса записывается следующим образом
φOx/Red = φ0Ox/Red + 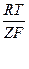 ln (aOx/aRed) (18).
ln (aOx/aRed) (18).
Зависимость электродного потенциала от природы окислительно-восстановительной системы характеризуется величиной φ0Ox/Red, которую обычно находят из справочных таблиц, зависимость от температуры и активностей окисленной и восстановленной форм определяется вторым слагаемым из (18).
Потенциал окислительно-восстановительной системы увеличивается с ростом температуры и активности окисленной формы и уменьшается с ростом активности восстановленной формы.
Дата добавления: 2017-02-13; просмотров: 3130;











