Общие понятия и определения окислительно-восстановительных реакций.
Все многообразие химических реакций можно свести к двум типам. Если в результате реакции степени окисления элементов не изменяются, то такие реакции называют обменными, в противном случае – окислительно-восстановительными реакциями.
Протекание химических реакций обусловлено обменом частицами между реагирующими веществами. Например, в реакции нейтрализации происходит обмен между катионами и анионами кислоты и основания, в результате образуется слабый электролит – вода:
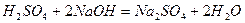
Часто обмен сопровождается переходом электронов от одной частица к другой. Так, при вытеснении цинком меди в растворе сульфата меди (II)
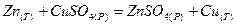
электроны от атомов цинка переходят к ионам меди:
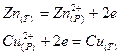
или
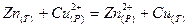 .
.
Процесс потери электронов частицей называют окислением, а процесс приобретения электронов – восстановлением. Окисление и восстановление протекают одновременно, поэтому взаимодействия, сопровождающиеся переходом электронов от одних частиц к другим, называют окислительно-восстановительными реакциями.
Передача электронов может быть и неполной. Например, в реакции
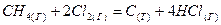
вместо малополярных связей С—Н появляются сильнополярные связи Н—Сl. Для удобства написания окислительно-восстановительных реакций используют понятие степени окисления, характеризующее состояние элемента в химическом соединении и его поведении в реакциях.
Степень окисления – величина, численно равная формальному заряду, который можно приписать элементу, исходя из предположения, что все электроны каждой его связи перешли к более электроотрицательному атому данного соединения.
Используя понятие степени окисления, можно дать более общее определение процессов окисления и восстановления. Окислительно-восстановительными называют химические реакции, которые сопровождаются изменением степеней окисления элементов участвующих в реакции веществ. При восстановлении степень окисления элемента уменьшается, при окислении – увеличивается. Вещество, в состав которого входит элемент, понижающий степень окисления, называют окислителем; вещество, в состав которого входит элемент, повышающий степень окисления, называют восстановителем.
Степень окисления элемента в соединении определяют в соответствии со следующими правилами:
· степень окисления элемента в простом веществе равна нулю;
· алгебраическая сумма всех степеней окисления атомов в молекуле равна нулю;
· алгебраическая сумма всех степеней окисления атомов в сложном ионе, а также степень окисления элемента в простом одноатомном ионе равна заряду иона;
· отрицательную степень окисления проявляют в соединении атомы элемента, имеющего наибольшую электроотрицательность;
· максимально возможная (положительная) степень окисления элемента соответствует номеру группы, в которой расположен элемент в Периодической системе Д.И. Менделеева.
Степень окисления атомов элементов в соединении записывают над символом данного элемента, указывая вначале знак степень окисления, а затем ее численное значение, например 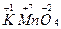 .
.
Ряд элементов в соединениях проявляет постоянную степень окисления, что используют при определении степеней окисления других элементов:
- фтор, имеющий наивысшую среди элементов электроотрицательность, имеет степень окисления -1;
- водород проявляет степень окисления +1, кроме гидридов металлов (-1);
- металлы IA подгруппы имеют степень окисления +1;
- металлы IIA подгруппы, а также цинк и кадмий имеют степень окисления +2;
- степень окисления алюминия +3;
- степень окисления кислорода равна -2, за исключением соединений, в которых кислород присутствует в виде молекулярных ионов:
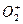 - пероксидного аниона,
- пероксидного аниона, 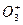 - озонидного аниона, а также фторидов кислорода ОxF2.
- озонидного аниона, а также фторидов кислорода ОxF2.
Окислительно-восстановительные свойства атомов различных элементов проявляются в зависимости от многих факторов, важнейшие из которых – электронное строение элемента, его степень окисления в веществе, характер свойств других участников реакции. Соединения, в состав которых входят атомы элементов с максимальной (положительной) степенью окисления, например, 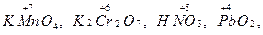 могут только восстанавливаться, выступая в качестве окислителей. Соединения, содержащие элементы с минимальной степенью окисления, например,
могут только восстанавливаться, выступая в качестве окислителей. Соединения, содержащие элементы с минимальной степенью окисления, например, 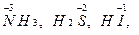 могут только окисляться и выступать в качестве восстановителей.
могут только окисляться и выступать в качестве восстановителей.
Вещества, содержащие элементы с промежуточными степенями окисления, например, 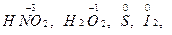 обладают окислительно-восстановительной двойственностью. В зависимости от партнера по реакции такие вещества способны и принимать (при взаимодействии с более сильными восстановителями), и отдавать (при взаимодействии с более сильными окислителями) электроны.
обладают окислительно-восстановительной двойственностью. В зависимости от партнера по реакции такие вещества способны и принимать (при взаимодействии с более сильными восстановителями), и отдавать (при взаимодействии с более сильными окислителями) электроны.
Состав продуктов восстановления и окисления также зависит от многих факторов, в том числе среды, в которой протекает химическая реакция, концентрации реагентов, активности партнера по окислительно-восстановительному процессу.
Чтобы записать уравнение окислительно-восстановительной реакции, необходимо знать, как изменяются степени окисления элементов и в какие другие переходят окислитель и восстановитель. Рассмотрим краткие характеристики наиболее часто употребляющихся окислителей и восстановителей.
Важнейшие окислители. Среди простых веществ окислительные свойства характеры для типичных неметаллов: фтора F2, хлора Cl2, брома Br2, йода I2, кислорода О2.
Галогены, восстанавливаясь, приобретают степень окисления -1, причем от фтора к йоду их окислительные свойства ослабевают (F2 имеет ограниченное применение вследствие высокой агрессивности):
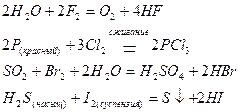
Кислород, восстанавливаясь, приобретает степень окисления -2:
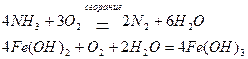
К наиболее важным окислителям среди кислородосодержащих кислот и их солей относятся азотная кислота HNO3 и ее соли, концентрированная серная кислота Н2SO4, кислородосодержащие кислоты галогенов ННаlOx и их соли, перманганат калия КМnО4 и дихромат калия К2Сr2O7.
Азотная кислота проявляет окислительные свойства за счет азота в степени окисления +5. При этом возможно образование различных продуктов восстановления:
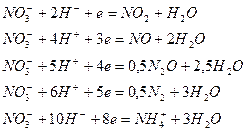
Глубина восстановления азота зависит от концентрации кислоты, а также от активности восстановителя, определяемой его окислительно-восстановительным потенциалом:

Рис.1. Глубина восстановления азота в зависимости от концентрации кислоты.
Например, окисление цинка (активный металл) азотной кислотой сопровождается образованием различных продуктов восстановления, ни про концентрации HNO3 примерно 2 % (масс.) преимущественно образуется NH4NO3:
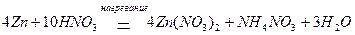
при концентрации HNO3 приблизительно 5 % (масс.) – N2O:
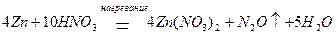
при концентрации HNO3 около 30 % (масс.) – NO:
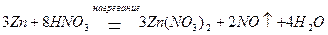
а при концентрации HNO3 примерно 60 % (масс.) преимущественно образуется – NO2:
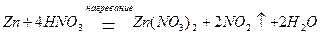
Окислительная активность азотной кислоты усиливается с ростом концентрации, поэтому концентрированная HNO3 окисляет не только активные, но и мало активные металлы, такие как медь и серебро, образуя преимущественно оксид азота (IV):
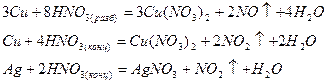
а также и неметаллы, такие как сера и фосфор, окисляя их до кислот, соответствующих высшим степеням окисления:
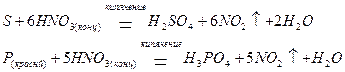
Соли азотной кислоты (нитраты) могут восстанавливаться в кислотной, а при взаимодействии с активными металлами и в щелочной средах, а также в расплавах:
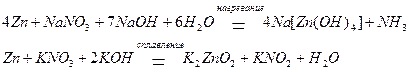
Царская водка – смесь концентрированной и азотной кислот, смешанных в соотношении 1:3 по объему. Название этой смеси связано с тем, что она растворяет даже такие благородные металлы, как золото и платина:
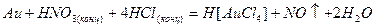
Протекание этой реакции обусловлено тем, что царская водка выделяет нитрозилхлорид NOCl и свободный хлор Cl2:
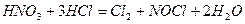
под действием которых металлы переходят в хлориды.
Серная кислота проявляет окислительные свойства в концентрированном растворе за счет серы в степени окисления +6:
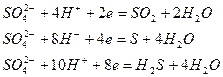
Состав продуктов восстановления определяется главным образом активностью восстановителя и концентрацией кислоты:
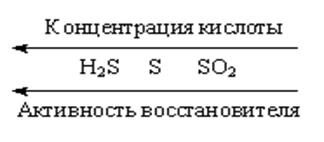
Рис.2. Восстановительная активность серы в зависимости от
концентрации кислоты.
Так, взаимодействие концентрированной Н2SO4 с малоактивными металлами, некоторыми неметаллами и их соединениями приводит к образованию оксида серы (IV):
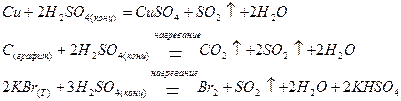
Активные металлы восстанавливают концентрированную серную кислоту до серы или сероводорода:
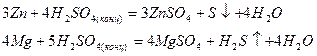
при этом одновременно образуются Н2S, S и SO2 в различных соотношениях. Однако и в этом случае основным продуктом восстановления Н2SO4 является SO2 , так как выделяющиеся S и Н2S могут окисляться концентрированной серной кислотой:
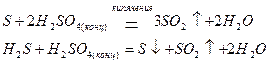
Кислородосодержащие кислоты галогенов и их соли (см. табл. П.1.1) часто используют как окислители, хотя многие из них проявляют двойственный характер. Как правило, продукты восстановления этих соединений – хлориды и бромиды (степень окисления -1), а также йод (степень окисления 0);
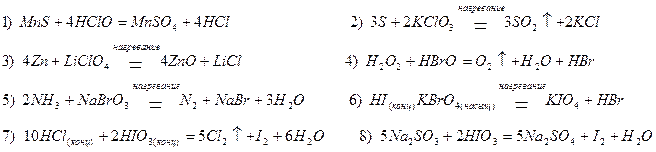
Однако и в этом случае состав продуктов восстановления зависит от условий протекания реакции, концентрации окислителя и активности восстановителя:
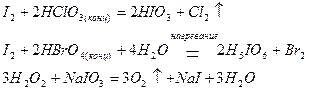
Перманганат калия проявляет окислительные свойства за счет марганца в степени окисления +7. В зависимости от среды, в которой протекает реакция, он восстанавливается до разных продуктов: в кислотной среде – до солей марганца (II), в нейтральной – до оксида марганца (IV) в гидратной форме MnO(O)2, в щелочной – до манганат-иона 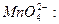
кислотная среда
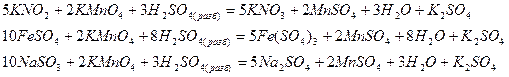
нейтральная среда
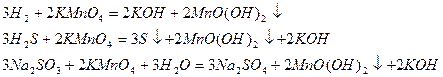
щелочная среда
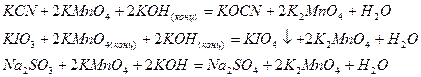
Дихромат калия, в состав молекулы которого входит хром в степени окисления +6, является сильным окислителем при спекании и в кислотном растворе
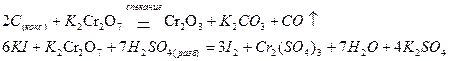
проявляет окислительные свойства и в нейтральной среде
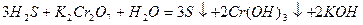
В щелочной среде равновесие между хромат- и дихромат-ионами
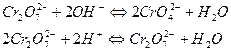
смещено в сторону образования 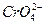 , поэтому в щелочной среде окислителем является хромат калия К2СrO4:
, поэтому в щелочной среде окислителем является хромат калия К2СrO4:
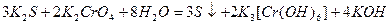
однако К2СrO4 более слабый окислитель по сравнения с К2Сr2O7.
Среди ионов окислительные свойства проявляют ион водорода Н+ и ионы металлов в высшей степени окисления. Ион водорода Н+ выступает как окислитель при взаимодействии активных металлов с разбавленными растворами кислот (за исключением НNO3)
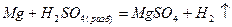
Ионы металлов в относительно высокой степени окисления, такие как Fe3+, Сu2+, Нg2+, восстанавливаясь, превращаясь в ионы более низкой степени окисления
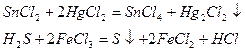
или выделяются из растворов их солей в виде металлов
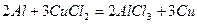
Важнейшие восстановители.К типичным восстановителям среди простых веществ относятся активные металлы, такие как щелочные и щелочно-земельные металлы, цинк, алюминий, железо и другие, а также некоторые неметаллы (водород, углерод, фосфор, кремний).
Металлы в кислотной среде окисляются до положительно заряженных ионов:
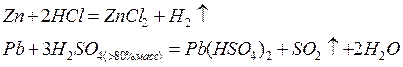
В щелочной среде окисляются металлы, проявляющие амфотерные свойства; при этом образуются отрицательно заряженные анионы или гидроксокомпаненты:
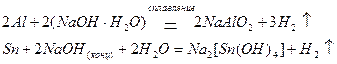
Неметаллы, окисляясь, образуют оксиды или соответствующие кислоты:
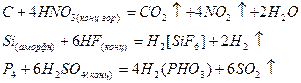
Восстановительными функциями обладают бескислородные анионы, например Cl-, Вr-, I-, S2-, Н- и катионы металлов в высшей степени окисления.
В ряду галогенид-ионов, которые, окисляясь, обычно образуют галогены:
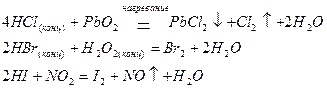
восстановительные свойства усиливаются от Cl- к I-.
Гидриды металлов проявляют восстановительные свойства за счет окисления связанного с водородом (степень окисления -1) до свободного водорода:
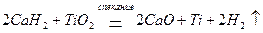
Катионами металлов в низшей степени окисления, таким как Sn2+, Fe2+, Cu+, Hg22+ и другим, при взаимодействии с окислителями свойственно повышение степени окисления:
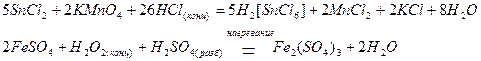
Окислительно-восстановительная двойственность.Среди простых веществОкислительно-восстановительная двойственность характерна для элементов VIIA,VIA и VA подгрупп, которые могут как повышать, так и понижать свою степень окисления.
Часто используемые как окислители галогены под действием более сильных окислителей проявляют восстановительные свойства (за исключением фтора). Их окислительные способности уменьшаются, а восстановительные свойства увеличиваются от Cl2 к I2:

Рис.3. Окислительно-восстановительная способность галогенов.
Эту особенность иллюстрирует реакция окисление йода хлором в водном растворе:
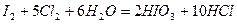
В состав кислородосодержащих соединений, проявляющих двойственность поведения в окислительно-восстановительных реакциях, также входят элементы в промежуточной степени окисления. Кислородосодержащие кислоты галогенов и их соли, в состав молекул которых входит галоген в промежуточной степени окисления, могут быть как окислителями
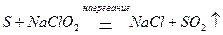
так и восстановителями
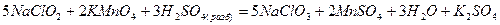
Пероксид водорода, содержащий кислород в степени окисления -1, в присутствии типичных восстановителей проявляет окислительные свойства, так как степень окисления кислорода может понижаться до -2:
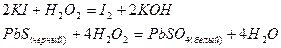
Последнюю реакцию используют при реставрации картин старых мастеров, краски которых, содержащие свинцовые белила, чернеют из-за взаимодействия с сероводородом воздуха.
При взаимодействии с сильными окислителями степень окисления кислорода, входящего в состав пероксида водорода, повышается до 0, Н2О2 проявляет свойства восстановителя:
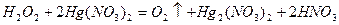
Азотистая кислота и нитриты, в состав которых входит азот в степени окисления +3, а также могут выступать как в роли окислителей
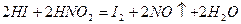
так и в роли восстановителей
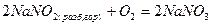
Классификация. Различают четыре типа окислительно-восстановительных реакций.
1. Если окислитель и восстановитель разные вещества, то такие реакции относятся к межмолекулярным. Примерами служат все рассмотренные реакции ранее.
2. При термическом разложении сложных соединений, в состав которых входят окислитель и восстановитель в виде атомов разных элементов, происходят окислительно-восстановительные реакции, называемые внутримолекулярными:
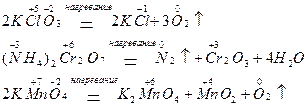
3. Реакции диспропорционирования (дисмутации или, согласно устаревшей терминологии, самоокисления - самовосстановления) могут происходить, если соединения, содержащие элементы в промежуточных степенях окисления, попадают в условия, где они оказываются неустойчивыми (например, при повышенной температуре). Степень окисления этого элемента и повышается, и понижается:
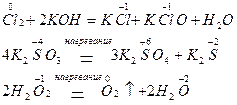
4. Реакции контрпропорционирования (конмутации) – это процессы взаимодействия окислителя и восстановителя, в состав которых входит один и тот же элемент с разными степенями окисления. В результате продуктом окисления и восстановления является вещество с промежуточной степенью окисления атомов данного элемента:
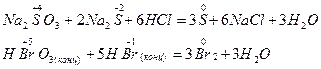
Существуют также реакции смешанного типа. Например, к внутримолекулярной реакции контрпропорционирования относится реакция разложения нитрата аммония
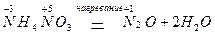
Составление уравнений.
Уравнения окислительно-восстановительных реакций составляют, основываясь на принципах равенства числа одних и тех же атомов до и после реакции, а также учитывая равенство числа электронов, отдаваемых восстановителем, и числа электронов, принимаемых окислителем, т.е. электронейтральность молекул. Реакцию представляют в виде системы двух полуреакций – окисления и восстановления, суммирование которых с учетом указанных принципов приводит к составлению общего уравнения процесса.
Для составления уравнений окислительно-восстановительных реакций наиболее часто используют метод электронно-ионных полуреакций и метод электронного баланса.
Метод электронно-ионных полуреакций применяют при составлении уравнений реакции, протекающих в водном растворе, а также реакции с участием веществ, степень окисления элементов которых трудно определить (например, KNCS, CH3CH2OH).
Согласно этому методу, выделяют следующие главные этапы составления уравнения реакций.
а) записывают общую молекулярную схему процесса с указанием восстановителя, окислителя и среды, в которой протекает реакция (кислотная, нейтральная или щелочная). Например
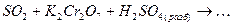
б) учитывая диссоциацию электролитов в водном растворе, данную схему представляют в виде молекулярно-ионного взаимодействия. Ионы, степени окисления атомов которых не изменяются, в схеме не указывают, за исключением ионов среды (Н+, ОН-):
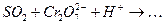
в) определяют степени окисления восстановителя и окислителя, а также продуктов их взаимодействия:
окисление восстановителя восстановление окислителя
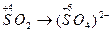
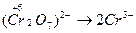
(Данный этап не является обязательным и его можно опустить, если определение степеней окислителя затруднительно. Скобки при записи аниона обычно не используются, но в данном случае необходимы, чтобы избежать путаницы при определении степени окисления элемента и заряда аниона).
г) записывают материальный баланс полуреакции окисления и восстановления:
окисление восстановителя восстановление окислителя
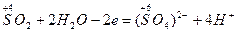
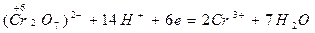
д) суммируют полуреакции, учитывая принцип равенства отданных и принятых электронов:
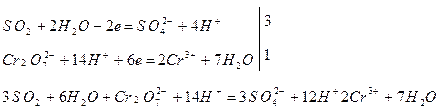
и, сокращая одноименные частицы, получают общее ионно-молекулярное уравнение
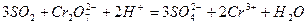
е) добавляют ионы, не участвовавшие в процессе окисления – восстановления, уравнивают их количество слева и справа, и записывают молекулярное уравнение реакции
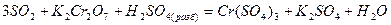
Наибольшие трудности возникают при составлении материального баланса полуреакций окисления и восстановления, когда изменяется число атомов кислорода, входящих в состав частиц окислителя и восстановителя. Следует учитывать, что в водных растворах связывание или присоединение кислорода происходит с участием молекул воды и ионов среды.
В процессе окисления на один атом кислорода, присоединяющийся к частице восстановителя, в кислотной и нейтральной средах расходуется одна молекула воды и образуются два иона Н+; в щелочной среде расходуются два гидроксид-иона ОН- и образуется одна молекула воды (табл.1.1).
Для связывания одного атома кислорода окислителя в кислотной среде в процессе восстановления расходуются два иона Н+ и образуется одна молекула воды; в нейтральной и щелочной средах расходуется одна молекула Н2О образуются два иона ОН- (табл.1, 2).
Таблица 1
Присоединение атомов кислорода к восстановителю в процессе окисления
| Среда | Частицы, участвующие в присоединении одного атома кислорода | Образующиеся частицы | Примеры полуреакций окисления |
| Кислотная, нейтральная Щелочная | Н2О 2ОН- | 2Н+ Н2О | 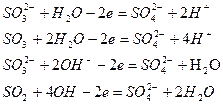
|
Таблица 2
Связывание атомов кислорода окислителя в процессе восстановления
| Среда | Частицы, участвующие в связывании одного атома кислорода | Образующиеся частицы | Примеры полуреакций восстановителя |
| Кислотная Нейтральная, щелочная | 2Н+ Н2О | Н2О 2ОН- | 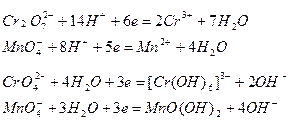
|
Достоинства метода электронно-ионных полуреакций заключается в том, что при составлении уравнений окислительно-восстановительных реакций учитываются реальные состояния частиц в растворе и роль среды в протекании процессов, нет необходимости использования формального понятия степени окисления.
Метод электронного баланса, основанный на учете изменения степени окисления и принципе электронейтральности молекулы, является универсальным. Его обычно используют для составления уравнений окислительно-восстановительных реакций, протекающих между газами, твердыми веществами и в расплавах.
Последовательность операций, согласно методу, такая:
1) записывают формулы реагентов и продуктов реакции в молекулярном виде:
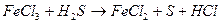
2) определяют степени окисления атомов, меняющих ее в процессе реакции:
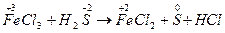
3) по изменению степеней окисления устанавливают число электронов, отдаваемых восстановителем, и число электронов, принимаемых окислителем, и составляют электронный баланс с учетом принципа равенства числа отдаваемых и принимаемых электронов:
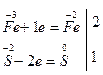
4) множители электронного баланса записывают в уравнение окислительно-восстановительной реакции как основные стехиометрические коэффициенты:
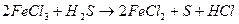
5) подбирают стехиометрические коэффициенты остальных участников реакции:
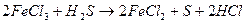
При составлении уравнений следует учитывать, что окислитель (или восстановитель) может расходоваться не только в основной окислительно-восстановительной реакции, но и при связывании образующихся продуктов реакции, то есть выступать в роли среды и солеобразователя.
Примером, когда роль среды играет окислитель, служит реакция окисления металла в азотной кислоте, составленная методом электронно-ионных полуреакций:
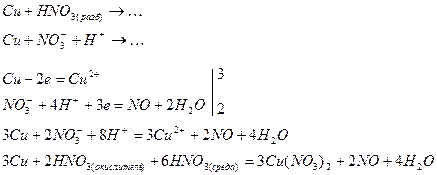
или
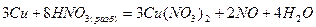
Примером, когда восстановитель является средой, в которой протекает реакция, служит реакция окисления соляной кислоты дихроматом калия, составленная методом электронного баланса:
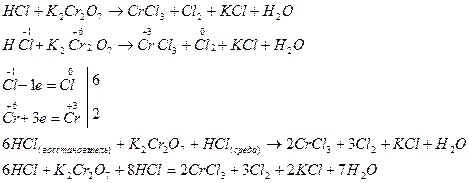
или
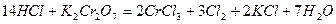
При расчете количественных, массовых и объемных соотношений участников окислительно-восстановительных реакций используют основные стехиометрические законы химии и, в частности, закон эквивалентов. Для определения направления и полноты протекания окислительно-восстановительных процессов используют значения термодинамических параметров данных систем, а при протекании реакций в водных растворах – значения соответствующих электродных потенциалов.
ПРИЛОЖЕНИЯ
Дата добавления: 2017-02-13; просмотров: 3183;











