Ионное произведение.
Электропроводность воды объясняется тем, что вода в очень малой степени диссоциирует, образуя ионы водорода и гидроксид-ионны:
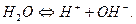
Этот процесс равновесен и, как любой равновесный процесс, его можно охарактеризовать константой равновесия, которая является константой диссоциации:
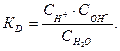
При комнатной температуре на ионы распадается лишь одна из 108 молекул воды.
Концентрацию молекул воды можно рассчитать, разделив массу 1л воды на массу 1 моля:
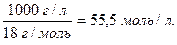
В разбавленных растворах концентрация воды изменяется очень мало и ее можно считать постоянной, тогда
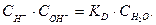
Так как 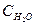 – константа, то вносят в КD и обозначают КW:
– константа, то вносят в КD и обозначают КW:
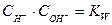 (11).
(11).
Эта величина называется ионным произведением воды и представляет собой постоянную величину при данной температуре.
В чистой воде при комнатной температуре концентрация ионов водорода и гидроксид-ионов равны между собой и равны 10–7моль/л. Следовательно:
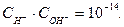
Константа равновесия КW зависит от температуры и не зависит от концентрации катионов Н+ и анионов ОН–.
Если в воду добавить кислоту, то концентрация катионов водорода увеличится, равновесие сместится влево, а концентрация гидроксид-ионов уменьшится так, что ионное произведение воды останется неизменным.
Таким образом, в водных растворах, при постоянной температуре, концентрация катионов водорода и гидроксид-ионов связаны между собой. При расчетах для водных растворов сильных электролитов используют не концентрации, а активности:
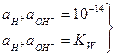
Водородный показатель
Для характеристики кислотности (щелочности) среды введен специальный параметр – водородный показатель или рН. Водородным показателем или рН называют взятый с обратным знаком десятичный логарифм концентрации водородных ионов в растворе:
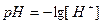 (12).
(12).
Водородный показатель определяет характер реакции раствора. Например, при 295К она нейтральна и рН=7 (концентрация ионов водорода равна [Н+]=10–7моль/л). При рН<7 (концентрация ионов водорода [Н+] >10–7моль/л) реакция раствора кислая, при рН>7 (концентрация ионов водорода [Н+] <10–7моль/л) – щелочная. С изменением температуры величина ионного произведения воды КW изменяется.
Величина рН может служить критерием силы кислоты или основания. В ряду кислот будет сильной та, у которой при одинаковой молярной концентрации активность ионов Н+ выше (рН ниже). Для оснований подобная зависимость носит обратный характер.
Дата добавления: 2017-02-13; просмотров: 1621;











