Механизм образования оксидов азота
Азот – одно из самых распространённых веществ на Земле. В свободном состоянии он не оказывает отрицательного воздействия на человека и окружающую среду, однако практически все соединения азота являются токсичными[9, с. 40].
Азот и с кислородом образует 8 оксидов (оксид NО, диоксид NО2, пероксид NО3, гемиоксид N2О, азотистый ангидрид N2О3, тетраоксид диазота N2О4, азотный ангидрид N2О5 и гексаоксид диазота N2О6), из которых основную роль в загрязнении атмосферы играют NO и NO2,и в меньшей степени –N2O. Загрязняют атмосферу первые пять соединений, последние существуют лишь в специфических условиях.
Оксид азота NO – бесцветный газ; с водой, кислотами и щелочами химически не взаимодействует, плохо в них растворим. Является при обычной температуре устойчивым, разлагается, начиная с 670 ºС, при температуре выше 1200 ºС полностью диссоциирует на азот и кислород. При наличии кислорода самопроизвольно окисляется до NO2.
Диоксид азота NО2 – красновато-бурый газ с удушливым запахом, сильный окислитель, образуется в результате окисления NO кислородом. При нагревании до 150 ºС NO2 начинает разлагаться на оксид азота и кислород. В присутствии восстановителей и катализаторов NO2 разлагается на азот и воду. NO2 легко вступает в реакцию с аммиаком и щелочными металлами с образованием солей (NH4NO2, NaNO2, NaNO3), которые разлагаются при температуре 370 ºС.
Гемиоксид (закись азота) N2О (веселящий, анестезирующий газ) – бесцветен, со слабым приятным запахом и сладковатым вкусом. При нормальной температуре не вступает в реакцию даже с галогенами, щелочными металлами и озоном. При температуре выше 900 ºС разлагается на азот и кислород.
Трехокись азота N2O3– существует в твердом состоянии, только при низких температурах, в виде жидкости и пара она в значительной степени диссоциирует на NO и N2O.
Четырёхокись азота N2O4– образуется из двуокиси азота путем полимеризации. NO2 и N2O4 находятся в равновесии, зависящем от температуры. При температуре –11,2 ºС и ниже оксиды азота существуют в виде молекул N2O4 в жидком и твердом состоянии соответственно. При 100 ºС N2O4 испаряется, пары на 90% состоят из NO2. Полная диссоциация молекул N2O4 наступает при 140 ºС.
Пятиокись азота N2O5– является ангидридом азотной кислоты, существует при низких температурах в виде кристаллов азотного ангидрида, в газовой фазе N2O5 диссоциирует на NO2 и NO3.
В атмосферу выбрасываются лишь газообразные оксиды азота в виде N2O, NO, NO2 и N2O3, наблюдается одновременное присутствие всех оксидов (NOx).
NO и NO2 относятся к наиболее опасным загрязняющим веществам. Количество этих газов имеет тенденцию к сравнительно быстрому увеличению, они обладают высокой токсичностью и играют основную роль в фотохимических реакциях образования смога. Борьба с оксидами азота технологическими методами осложняется тем, что их образование происходит при интенсивном сжигании топлива. Известные технологические методы борьбы с NOХ связаны с увеличением образования при горении СО, ПАУ и С20Н12.
В результате развития промышленности и транспорта антропогенное загрязнение атмосферы оксидами азота быстро увеличивается. Данные, приведённые на рисунке 6.1, наглядно иллюстрируют это на примере загрязнения атмосферы США.
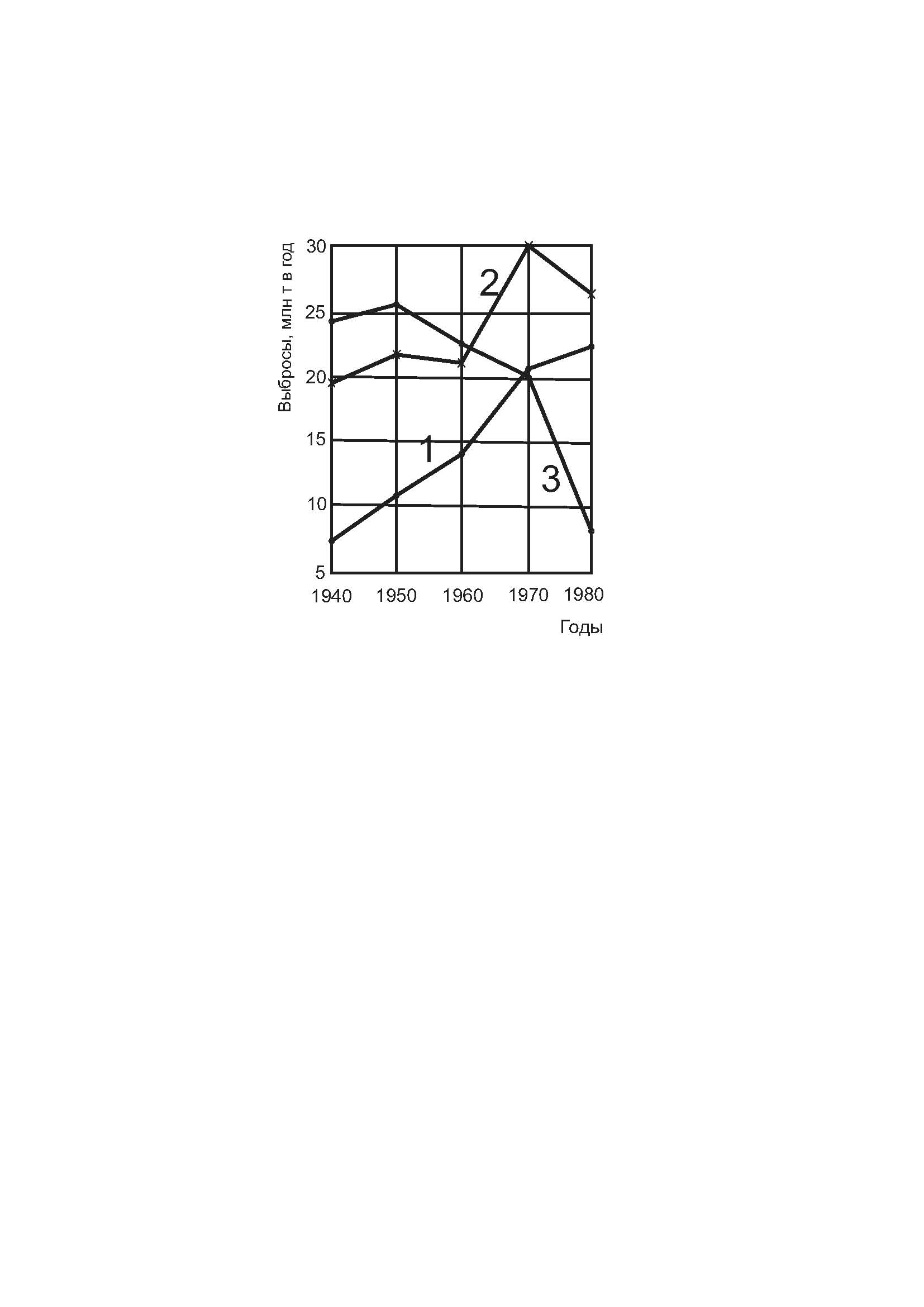
1 – NO2; 2 – SO2; 3 – твердые частицы
Рисунок 6.1 – Антропогенные выбросы в атмосферу в США
За 40 лет выбросы NO2 в атмосферу США увеличились более чем в 3 раза, количество же твёрдых частиц, поступивших в атмосферу за тот же период, наоборот уменьшилось в 3 раза; количество SO2 возросло на 35 %. Приблизительно можно считать, что через каждые 20-25 лет выбросы NO2 (оксидов азота в пересчёте на NO2)удваиваются. Естественные фоновые концентрации NO2 лежат в пределах 0,4-9,5 мкг/м3.
.
Таблица 6.1 – Термодинамическая возможность образования соединений азота
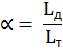
| Состав | Температура, °С | ||
| t ≤ 1000 | 1000 < t < 1500 | t >2000 | ||
| α ≤ 0,2 | N2 + O2 + C | CN, C2N2 | CN, C2N2 | CN, C2N2 |
| N2 + O2 + H2 | HCN, NH3 | HCN, NH3 | HCN | |
| 0,2 < α < 1 | N2 + O2 + C | NO | NO | NO |
| C + N2 + O2 + H2 | HCN, NH3 | HCN, NH3 | NO | |
| α ≥ 1 | C + N2 + O2 | NO | NO | NO |
| C + N2 + O2 + H2 | NO | NO | NO |
При отсутствии водорода при низких температурах (< 1000 ºС) единственным значащим соединением азота является дицианид С2N2, на долю которого приходится 100 % всех соединений азота. При повышении Т до 1500 ºС появляется СN, и при 2000 ºС это соединение превалирует над С2N2. В зоне высоких температур окисление этих соединений начинается уже при коэффициенте расхода воздуха α = 0,2, образуется NO (оксид азота), который становится единственным соединением азота в газовой фазе. При наличии водорода в газовой фазе появляется NН3 и НСN.
Образование оксидов азота протекает по следующим основным реакциям:
| C2N2 + 4CO2 = 2 NO + 6 CO | (6.1) |
| CN + 2 CO2 = NO + 3 CO | (6.2) |
| НCN + 2 CO2 = 2 NO + 3 CO+ 0,5 Н2 | (6.3) |
| NН3 + CO2 = NO + CO+ 1,5 Н2 | (6.4) |
| N2 + O2 = 2 NO | (6.5) |
Расчет образования NO проводят по реакции 6.5. Исходя из константы этой реакции, вывели следующее уравнение:
NO = k ∙ α ∙ β ∙ Lт ∙ ( 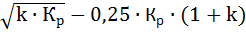
| (6.6) |
где α – коэффициент расхода воздуха;
β – количество сгоревшего топлива;
Lт – теоретический расход кислорода;
Кр – константа равновесия реакции;
k – коэффициент, зависящий от горелки и топочного агрегата.
На рисунке 6.2 представлена расчетная зависимость образования оксида азота от температуры в зоне реакции, согласно которой начиная с 700 °С наблюдается резкий рост образования оксидов азота, и температура становится определяющим фактором в этом процессе. Следовательно, все факторы, повышающие температуру факела и дымовых газов, а также увеличение времени пребывания их в печи должны увеличивать выброс оксидов азота.
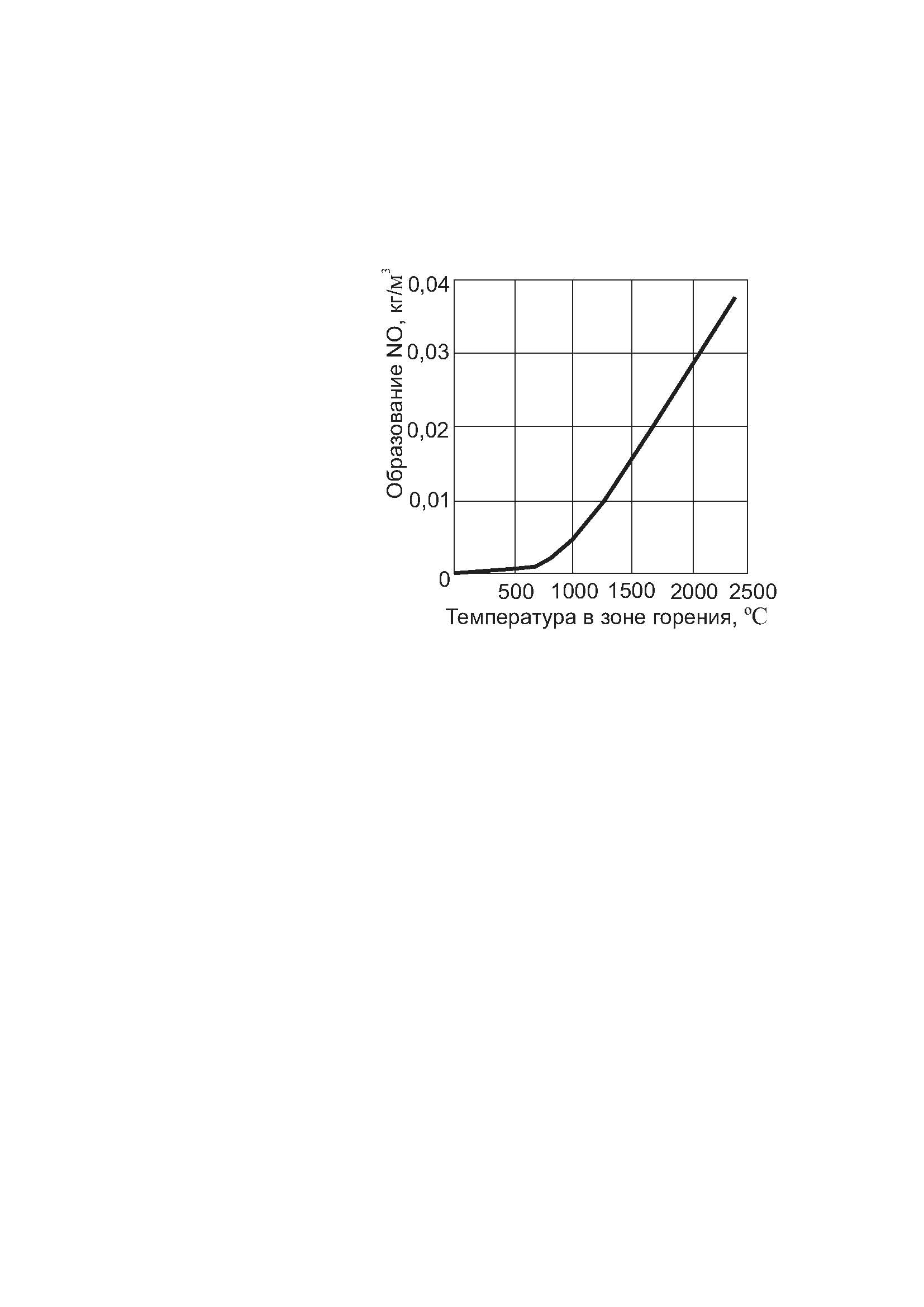
Рисунок 6.2 –Зависимость образования оксидов азота от температуры в зоне реакции
Оксиды азота относятся ко 2-му классу опасности для человека и определяют токсичность продуктов сгорания угля и мазута на 40-50 %, а природного газа на 90-95 %, хотя по массовым количествам выбросы NOx и уступают пыли, SO2 и СО. Более 95 % от общего количества промышленных выбросов NOx во всем мире поступает в атмосферу с продуктами сгорания топлива, и при этом порядка половины из них обусловлены выбросами теплоэнергетических установок.
Основными источниками образования NOx при сжигании топлива являются прямой их синтез в факеле при температурах не ниже 1827-1927 °С из азота и кислорода (так называемые «термичесике NOx») и образование NOx за счет азотсодержащих веществ (NH3, HCN и др.), содержащихся в топливе или образующихся при его пиролизе (так называемые «топливныеNOx») преимущественно при пониженных температурах (727-1227 °С)[12, с. 64].
Соотношение между термическими и топливными NOx зависит от ряда факторов (химического состава топлива, температурного режима его сжигания и т.д.). Полярными случаями здесь являются: сжигание природного газа, при котором образуются преимущественно термические NOx, и низкотемпературное сжигание углей (топливные NOx).
Помимо максимальной температуры решительное влияние на образование NO+ оказывает время реакции, характеризуемое темпом охлаждения в зоне максимальных температур.
Зельдович предложил цепную схему окисления N2, в которой наиболее активную роль играют свободные атомы О2 и N2:
O2 + M 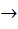 O + O + M (инициирование) O + O + M (инициирование)
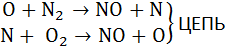 O + O + M
O + O + M 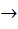 O2 + M (обрыв цепи) O2 + M (обрыв цепи)
| (6.7) |
Скорость образования реакции равна:
dCNO / dτ = 2 ∙ Кр ∙ Со ∙ 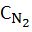
| (6.8) |
Эта скорость зависит от температуры (через константу скорости Кр) и концентраций атомарного О и молекул N2. СО в свою очередь зависит от 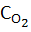 (концентрации О2 в продуктах сгорания).
(концентрации О2 в продуктах сгорания).
Таким образом, концентрация оксидов азота линейно увеличивается с увеличением концентрации атомарного О2 и экспоненциально – с увеличением температуры.
По Лаврову зависимость равновесной концентрации NO от α и температуры в топочном объеме выглядит следующим образом при сжигании метано-воздушной смеси): рисунок 6.3.
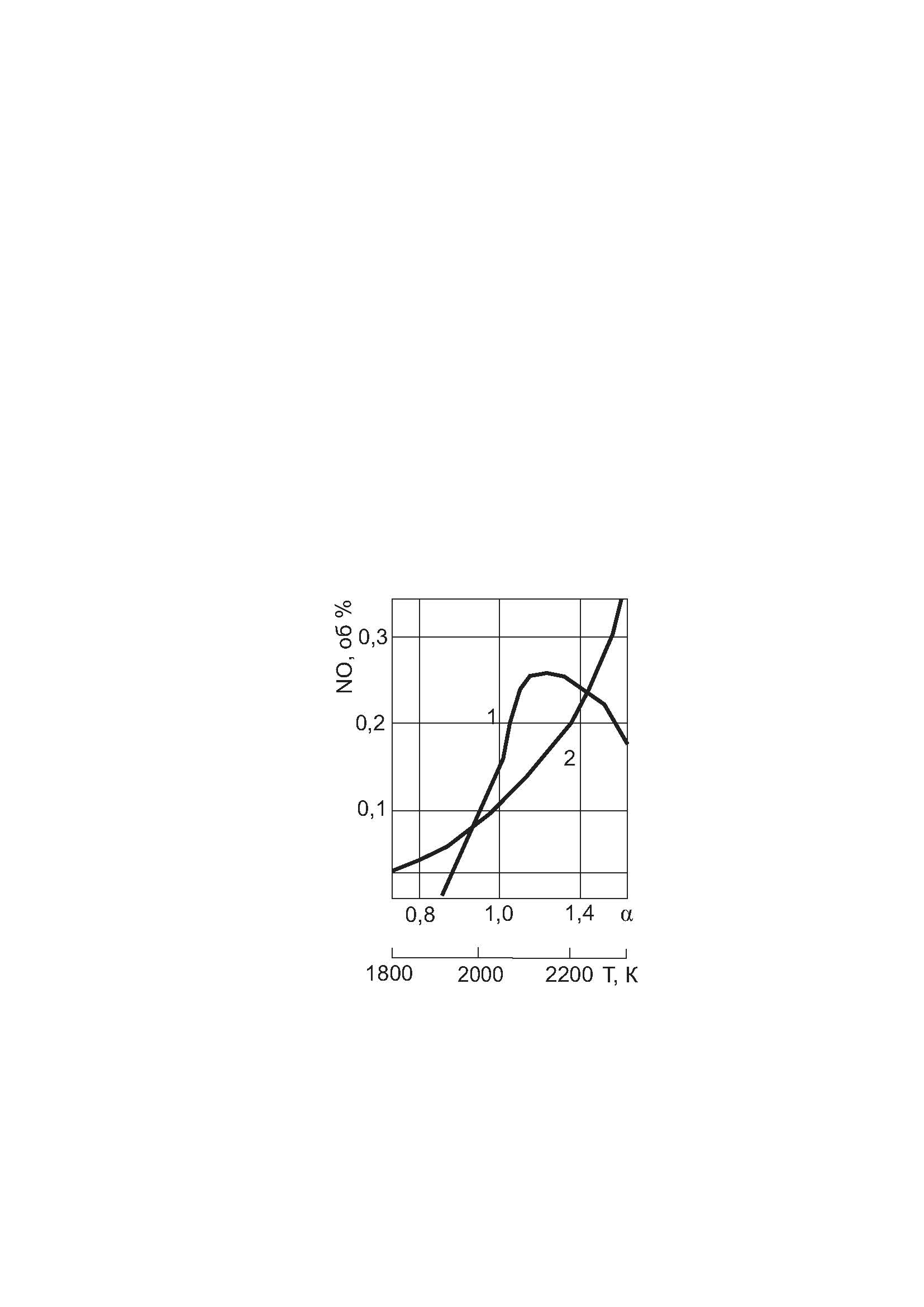
Рисунок 6.3 – Зависимость равновесной концентрации NO от α и температуры
Помимо максимальной температуры решительное влияние на образование NO оказывает время реакции, характеризуемое темпом охлаждения в зоне максимальных температур.
Для топочных камер больших размеров характерны медленный темп охлаждения продуктов сгорания (являющийся функцией высоты и объема камеры) и больший, чем для малых топок, период реакции синтеза NO. Поэтому выход «термических» NOx в топочных камерах больших энергоблоков (природный газ) составляет 0,8-1,5 г/м3, а в малых промышленных и отопительных котлах – 0,1-0,2 г/м3.
«Топливные» NOx образуются главным образом при сжигании твердого топлива, хотя не исключено их образование при сжигании коксового газа (содержащего NH3и HCN), доменного газа (HCN) и мазута. При сжигании высокозольных экибастузских углей (NP – 1-1,7 %) и бурых углей (NP = 0,6-1,1 %), а также в топках с «кипящим» слоем температура горения не превышает 1327-1427 °С. При этой температуре выход «термических» NOx невелик, а выход «топливных» NOx доходит до 75-80 % от общего их количества.
Топливные NOx образуются из азотсодержащих соединений топлива при продувке горячим воздухом уже при температурах 627-727 °С, т.е. на начальных участках факела, где воспламеняются и горят летучие. В NO переходит отнюдь не весь азот топлива, а в среднем обычно не более 2-3 % от общего его количества (для кузнецких углей, кстати наиболее богатых по NP– 16-20 %). В летучих веществах при сгорании углей обнаруживаются пиридин, хинолин, другие азотсодержащие углеводороды, HCN, NH3 и т.д.
Соотношение между отдельными видами NOx зависит от вида сжигаемого топлива, температуры топочного процесса и других факторов. При сравнительно низких температурах (< 1227 °С) в топках «кипящего» слоя или при сжигании относительно низкосортных твердых топлив доля NOx топливных велика. При температурах топочного процесса 1227-1727 °С в зависимости от вида топлива (уголь, мазут, газ) могут одновременно присутствовать все 3 вида NOx (для газа это практически нацело «термические» NOx и имеется некоторое количество «быстрых» NOx).
В области температур 2527-2927 °С (возможных при работе МГД-генераторов) следует ожидать очень высокого выхода «термических» NOx (порядка 14-18 г/м3 против 0,1-1,5 г/м3 для дымовых газов котлов) (рисунок 6.4).
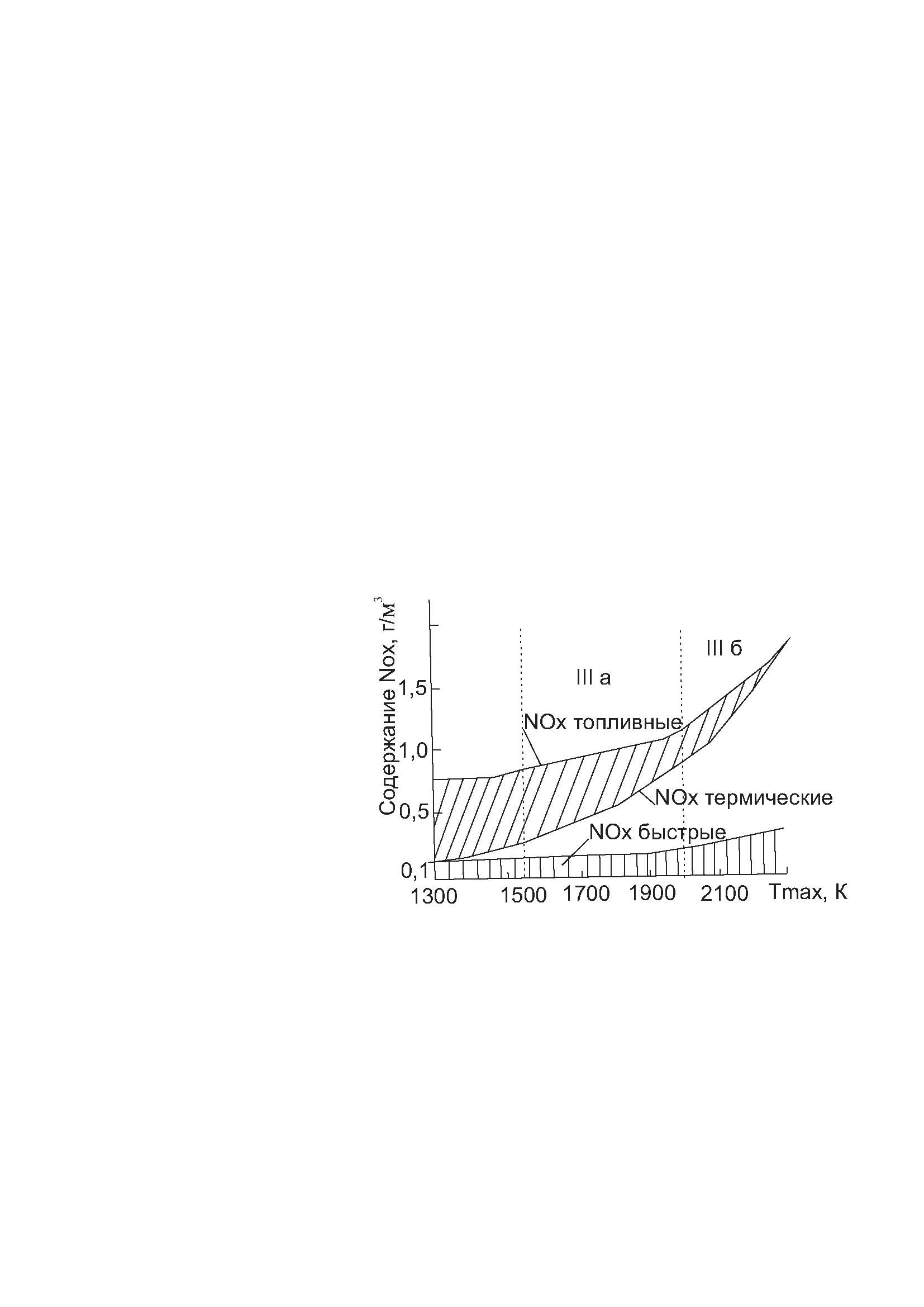
IIIа – бурые угли и другое низкосортное топливо; III б – каменный уголь, мазут, природный газ
Рисунок 6.4 – Схема образования NOx в топках котлов
Таким образом, подытоживая, можно сказать, что величина выбросов NOx с отходящими газами котлоагрегатов зависит от вида топлива, температуры процесса, концентрации кислорода в факеле (α), времени пребывания и темпов охлаждения продуктов сгорания в топочном объеме (зависящих от объема топочных камер).
Влияние мощности теплоэнергетического агрегата и вида топлива на концентрацию NOx (г/м3) в выбрасываемых газах представлено в таблице 6.2.
Таблица 6.2 – Влияние теплоэнергетического агрегата на выбросы NOx
| Парогенератор | Концентрация NOx, г/м3 | ||
| каменный уголь | мазут | природный газ | |
| 1250 т/ч | 0,8-1,5 | 0,8-1,5 | 1,3-1,8 |
| 475-950 т/ч | 0,4-1,0 | 0,6-1,1 | 0,7-1,1 |
| 170-230 т/ч | 0,25-0,5 | 0,2-0,3 | 0,25-0,40 |
| малые котельные | 0,2-0,5 | 0,15-0,3 | 0,1-0,2 |
Кислотные дожди. Под воздействием солнечного света в атмосферном воздухе протекает реакция с радикалами 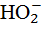 и
и 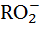 , образующимися в результате фотохимической реакции гидроксила ОН- с углеводородами:
, образующимися в результате фотохимической реакции гидроксила ОН- с углеводородами:
NO + НО2 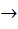 NO2 + ОН NO2 + ОН
| (6.9) |
NO + RО2 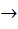 NO2 + RO NO2 + RO
| (6.10) |
Образование азотной кислоты наиболее вероятно в результате следующей реакции:
2 NO2 + H2O 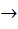 HNO2 + HNO3 HNO2 + HNO3
| (6.11) |
Следует учитывать, что часть азотной кислоты, образовавшаяся в ночное время, разлагается под воздействием солнечного света в утренние часы.
Образование азотной кислоты в дневное время происходит через NO2:
NO2 + ОH 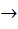 HNO3 + H ↑ HNO3 + H ↑
| (6.12) |
в ночное время – через N2O5:
NO2 + О3 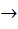 NO3 + O2 NO3 + O2
| (6.13) |
NO2 + О3 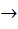 N2O5 N2O5
| (6.14) |
N2O5 + Н2О 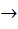 2 НNO3 2 НNO3
| (6.15) |
Влияние типа горелок на образование NOx
Уровень концентраций NOx в отходящих газах в значительной мере зависит не только от вида топлива, характера и конструкции топочного устройства, но и от конструктивных особенностей горелочных устройств.
Горелочные устройства могут быть разделены на 3 основные группы по степени смешения газа с воздухом:
– газ и воздух не смешиваются и подаются в топку раздельно спутными потоками; горение здесь осуществляется в наиболее длинном светящемся факеле;
– в горелку подается все количество воздуха, необходимое для горения, но из-за короткого пути смешения и других факторов не обеспечивается завершение смешения газа с воздухом;
– весь необходимый для горения воздух подается и смешивается с газом в горелке.
К первому типу относятся горелочные устройства мартеновских и стекловаренных печей, а ко второму – горелочные устройства котлов.
Для уменьшения длины факела и улучшения смешения топлива с воздухом применяются следующие методы:
– дробление газового потока на ряд мелких струй;
– увеличение угла встречи газового и воздушного потока;
– закрутка воздушного потока (а следовательно и всего факела);
– увеличение параметра зажигания топливовоздушной смеси.
Среди факторов, оказывающих наибольшее воздействие на уровень температур в факеле и время пребывания продуктов горения в зоне высоких температур, необходимо назвать нагрузку горелки (или тепловое напряжение) и степень турбулизации факела (или степень крутки).
По данным немецких исследователей, влияние нагрузки на горелку отопительного котла по-разному сказывается на концентрации NOx в отходящих газах в зависимости от характера смешения топлива с воздухом (рисунок 6.5).
При возрастании нагрузки смесеобразование в горелках без смешения (кривые 1 и 2) улучшается, что приводит к росту NOx; для горелок с частичным предварительным смешением уровень NOx от нагрузки практически не зависит. Последнее, однако, более или менее справедливо (по данным Сигаля) только при малых α (1-1,05) и в определенном диапазоне нагрузок. Например, при α = 1,3 увеличение нагрузки даже для подготовленных смесей привело к увеличению СNOx с 001 до 0035 г//м3 (т.е. почти в 2 раза).
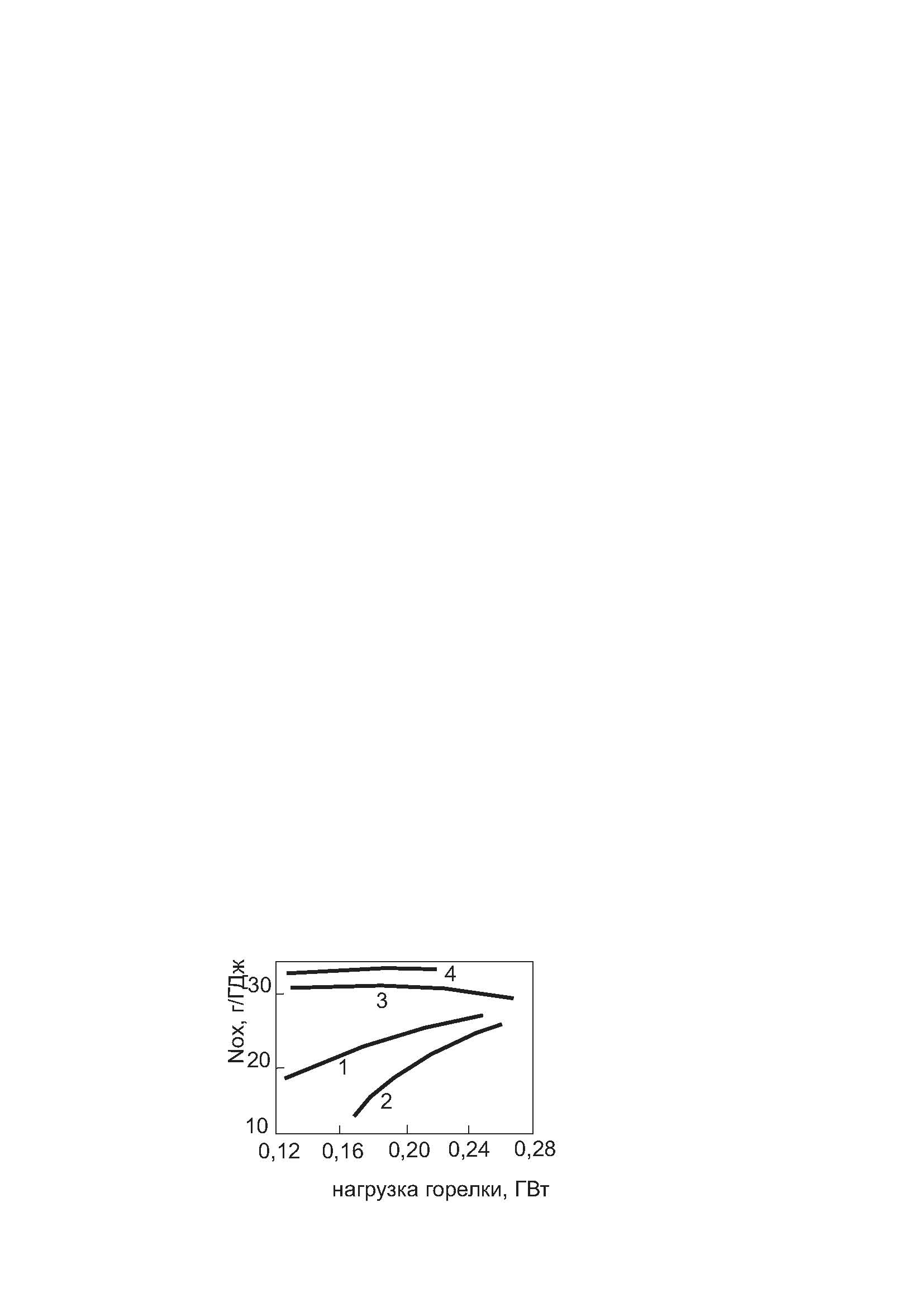
1, 2 – горелки без предварительного смешения воздуха с топливом; 3, 4 - горелки с частичным предварительным смешением
Рисунок 6.5 – Влияние нагрузки горелки на выбросы NOx
Турбулизация факела путем закручивания воздушного потока за счет его подачи тангенциально относительно газового потока или при помощи улиточного устройства может неоднозначно влиять на характер образования NOx. С одной стороны, при крутке воздушного потока увеличивается подсос рециркулирующих газов к корню струи, что может снизить СNOx за счет некоторого понижения температуры. С другой – интенсификация смешения топлива с воздухом укорачивает факел, увеличивает уровень максимальных температур в нем и сдвигает температуру-максимум к горелке. Это, в свою очередь, должно приводить к росту концентрации NOx.Очевидно, при определенных условиях может преобладать тот или иной фактор, что и объясняет некоторые разночтения в литературе по поводу влияния степени крутки потока в горелке на образование NOx.
При увеличении степени крутки, особенно выше критической (за критическую принимают степень крутки, при которой в закрученной струе начинает формироваться зона внутренней циркуляции) концентрация NOx в продуктах горения может существенно возрастать, что объясняется в первую очередь увеличением интенсивности горения и ростом уровня температур в факеле.
Так, по данным Сигаля, переход от прямого факела к закрученному (при степени крутки n = 1,86) сопровождается ростом содержания NOx в продуктах сгорания в 2,4 раза. Рост концентрации NOx от степени крутки nпредставлен на рисунке 6.6.
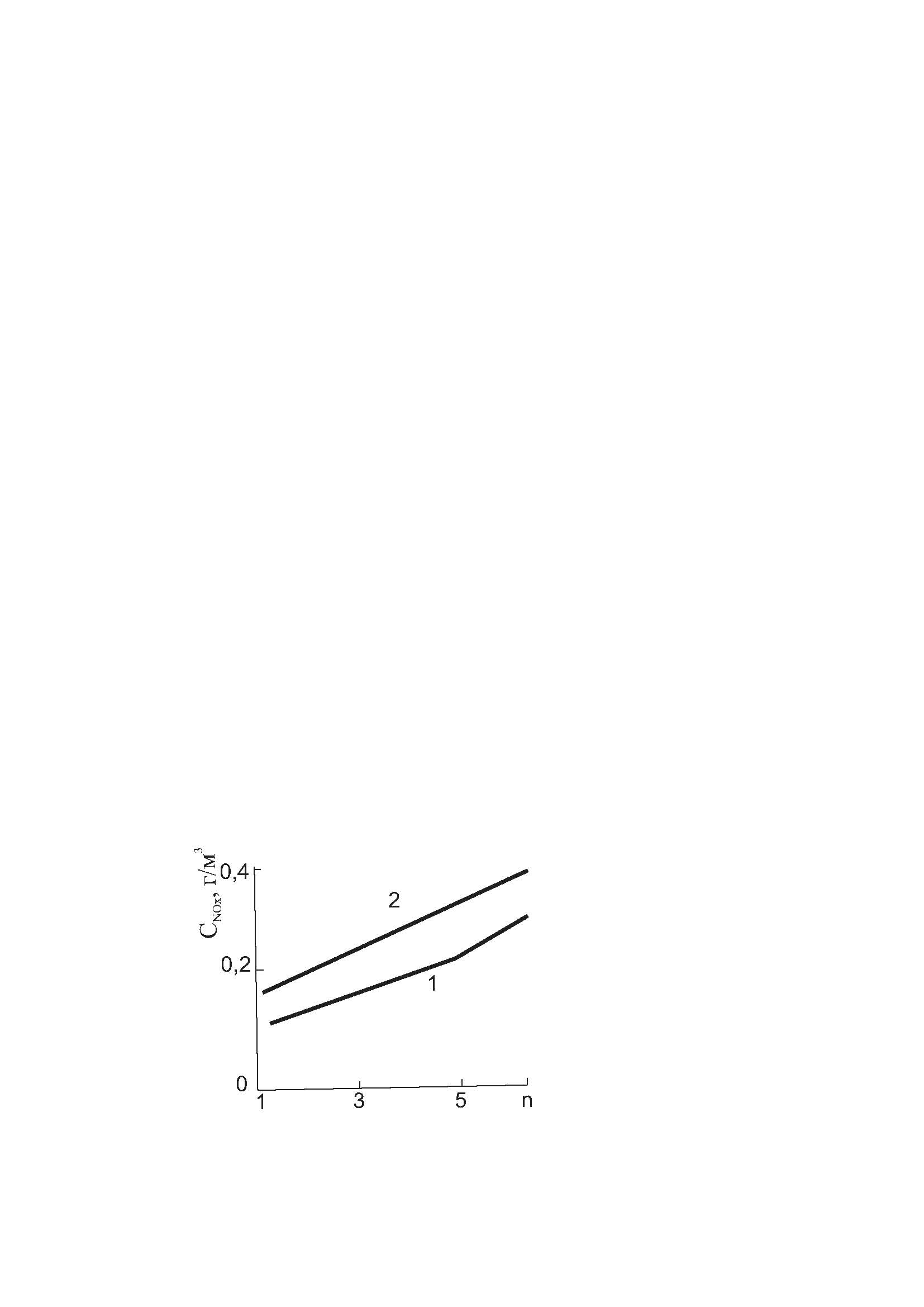
Рисунок 6.6 – Зависимость концентрации оксидов азота от степени крутки
По данным Сигаля, в интервале степеней крутки 1,2-577 концентрация NOx подчиняется следующему уравнению:
| СNOx = (1+n)0.83 1 – α = 1,05; 2 – α = 1,2 | (6.18) |
| n (для тангенциального подвода) = dk∙ (dk–a) / (a∙b) | (6.19) |
где dk – диаметр горелки;
a, b– ширина и длина тангенциального подвода.
Увеличение количества первичного воздуха, подаваемого на предварительное смешение с газом, при крутке воздушного потока оказывает незначительное влияние на процесс горения и образования вредных веществ.
В литературе имеются данные, что степень крутки не оказывает существенного влияния на концентрацию NOx при сжигании угольной пыли и мало влияет при сжигании мазута. Определенное воздействие на СNOx может оказать конструкция форсунки. В частности, минимальный уровень концентрации NOx наблюдается для пневматических форсунок, для паровых форсунок (< 100 °С) он был выше в среднем в 1,5-1,7 раза.
При выборе горелок и оптимальных параметров их работы не следует забывать о том, что выход других вредных компонентов в продуктах сгорания может и не подчиняться закономерностям, рассмотренным для NOx. Например, выход NOx достигает максимума при α = 1,1-1,2 и снижается при уменьшении α до значений 008-009. Между тем, при α = 0,8-0,9 резко увеличивается концентрация бенз[а]пирена. Концентрация NOxс увеличением степени крутки, как мы выяснили, в большинстве случаев увеличивается, тогда как бенз[а]пирена наоборот уменьшается.
В заключение следует отметить, что конструкция горелок и параметры их работы оказывают все же меньшее воздействие на концентрацию NOx, нежели конструкционные и технологические особенности печного агрегата.
Дата добавления: 2017-01-26; просмотров: 8427;











