Вынос сернистых соединений и их расчет
Диоксид серы (ПДКм.р. 10 мг/м3) – один из самых вредных и неприятных газов среди загрязнителей воздуха. Хотя средняя концентрация его в воздухе больших городов не столь велика по сравнению с другими компонентами, этот оксид считается наиболее опасным для здоровья горожан – он вызывает заболевания органов дыхания, общее ослабление организма и в сочетании с другими загрязнителями ведет к сокращению средней продолжительности жизни.
Во время трагического Лондонского тумана в 1952 г. более 4 000 смертей было отнесено на счет повышенного содержания в атмосфере диоксида серы. Однако обнаружено, что в печени млекопитающих содержится фермент сульфитоксидаза, содержащий молибден и способный детоксицировать диоксид серы. Детоксикация осуществляется путем окисления сульфита в сульфат (последний большей частью выводится с мочой):
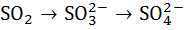
| (5.1) |
В промышленном производстве сера выбрасывается в окружающую среду в виде таких токсичных соединений, как SO2, COS и H2S[9, с. 30]. Эти соединения образуются в результате выгорания серы из железосодержащей шихты, угля, топлива, а также жидкого металла и шлака. Газообразные соединения серы в дымовых газах являются продуктами комплекса как минимум 17 химических реакций. К главным из них можно отнести следующие реакции:
| С + 0,5 О2 + S = COS; | (5.2) |
| COS + O2 = СО + SO2; | (5.3) |
| S + O2 = SО2; | (5.4) |
| H2 + 0,55S = SО2; | (5.5) |
| СаО + SO2 + 0,5O2 = СаSО4 | (5.6) |
Вероятность протекания тех или иных реакций в данных условиях можно определить путём анализа термодинамических характеристик процесса.
При выходе из дымовой трубы в дневное время под действием солнечного света сернистый ангидрид (SO2) окисляется в серный газ (SO3), который, соединяясь с водяными парами, даёт кислоты (Н2SO3, Н2SO4), оказывающие ещё более вредное воздействие на здоровье людей, разрушающие стальные конструкции, строительные материалы, снижающие прозрачность атмосферы, способствущие гибели хвойных лесов, плодовых деревьев, снижающие урожайность сельскохозяйственных культур.
Переход сернистого ангидрида (SO2) в серный (SO3) ускоряется наличием в дымовых газах оксидов азота:
| 2NO + SO2 = N2О + SO3 | (5.7) |
| NО2 + SO2 = NО + SO3 | (5.8) |
Рассчитывать выход соединений серы в дымовых газах можно только для окислительной области высоких температур, когда образуется только диоксид серы SO2 (сернистый ангидрид) по реакции:
| S + O2 = SО2; | (5.9) |
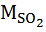 = 2 ∙ = 2 ∙ 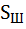 ∙ ∙ 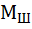
| (5.10) |
где 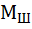 – масса шихты;
– масса шихты;
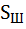 – массовая доля в ней серы.
– массовая доля в ней серы.
Таблица 5.1 – Условия образования соединений серы
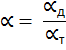
| Состав | Температура, °С | ||
| t ≤ 1000 | 1000 < t < 1200 | t > 1200 | ||
| α ≤ 0,2 | S + C | COS | COS | COS |
| S + C + Ca S + C + Ca + H2 | CaS | CaS | CaS |
| Окончание таблицы 5.1 | ||||
| 0,2 < α < 1 | S + C | COS + SO2 | ||
| S + C + Ca | CaS + COS | CaS + COS | CaS + COS | |
| S + C + Ca + H2 | CaS + H2S + SO2 | CaS + H2S + SO2 | CaS + H2S + SO2 | |
| α ≥ 1 | S + C | SO2 | SO2 | SO2 |
| S + C + Ca | CaSO4 | CaSO4 + SO2 | SO2 | |
| S + C + Ca + H2 | CaSO4 | CaSO4 | SO2 |
Примеры расчёта
При сжигании 1 т мазута, содержащего 4 % серы, образуется сернистый ангидрид в количестве:
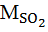 = 1 ∙ 0,04 ∙ 64 ∙(64 / 32) = 0,08 т,
= 1 ∙ 0,04 ∙ 64 ∙(64 / 32) = 0,08 т,
где 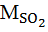 – молекулярная масса SO2;
– молекулярная масса SO2; 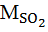 = 64;
= 64;
МS– молекулярная масса серы; 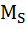 = 32.
= 32.
Таким образом, сернистого ангидрида образуется в два раза больше по сравнению с исходным содержанием серы в сырье.
При сжигании твердого топлива количество сернистого ангидрида определяется по формуле, кг/час:
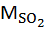 = 0,01 ∙ В ∙ SР∙(1 – = 0,01 ∙ В ∙ SР∙(1 – 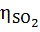 ) ∙ ) ∙ 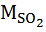 / МS, / МS,
| (5.11) |
где SР – содержание серы в топливе на рабочую массу, %;
В – расход топлива, кг/час;
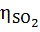 – доля оксидов серы, связанных летучей золой.
– доля оксидов серы, связанных летучей золой.
Доля оксидов серы, связанных летучей золой, при сжигании различных видов топлива установлена экспериментально и составляет:
Сланцы 0,5
Угли Канско-Ачинского бассейна 0,2
Торф 0,15
Экибастузский уголь 0,1
Остальные угли 0,1
Мазут 0,02
Газ 0,0
Сократить выброс оксидов серы можно первичными и вторичными методами.
Первичные методы – подавление образования оксидов серы.
Вторичные методы – улавливание оксидов серы из дымовых газов.
Дата добавления: 2017-01-26; просмотров: 2492;











