Очистка газов от оксидов азота
Методы очистки от оксидов азота основаны на их физико-химических свойствах. Разработаны окислительные, восстановительные, сорбционные и прочие методы. Классификация методов санитарной очистки газов от оксидов азота представлена на рисунке 6.7.
Окисление оксидов азота на низкотемпературных катализаторах. Окислительные методы санитарной очистки газов от NOxоснованы на предварительном окислении NO с последующим поглощением NO2 и N2Oразличными поглотителями. В промышленности используется метод гомогенного окисления в газовой фазе с помощью кислорода:
2 NO + O2  2 N2O 2 N2O
| (6.20) |
NO + NO2  N2O3 N2O3
| (6.21) |
Скорость реакции окисления оксида азота газообразным кислородом увеличивается в присутствии твердых тел и некоторых катализаторов. Наибольшую активность проявляют катализаторы, приготовленные на основе драгоценных металлов. Исследована каталитическая активность различных типов материалов, которые оказывают не одинаковое действие на скорость окисления азота. По каталитической активности их условно разделяют на 3 группы.
Первая группа – инертные вещества, которые не оказывают влияния на скорость реакции окисления NO: полиэтилен, шамот, тзвестняк, динос, кокс, доломит, оксид алюминия, катализатор марки БАВ, НТК-4.
Вторая группа – вещества, обладающие малой каталитической активностью: кварцевое стекло, полистирол, железная и марганцевая руда, катализатор марки ГИАП-10, стекловолокно.
Наиболее активны катализаторы третьей группы: кокс, промотированный солями марганца, меди, фосфора, стекло, алюмогель, уголь из абрикосовых косточек, силикагель, карбоалюмогель, гопкалит. Скорость реакции гетерогенного окисления оксида азота в 1,5-2,5 раза
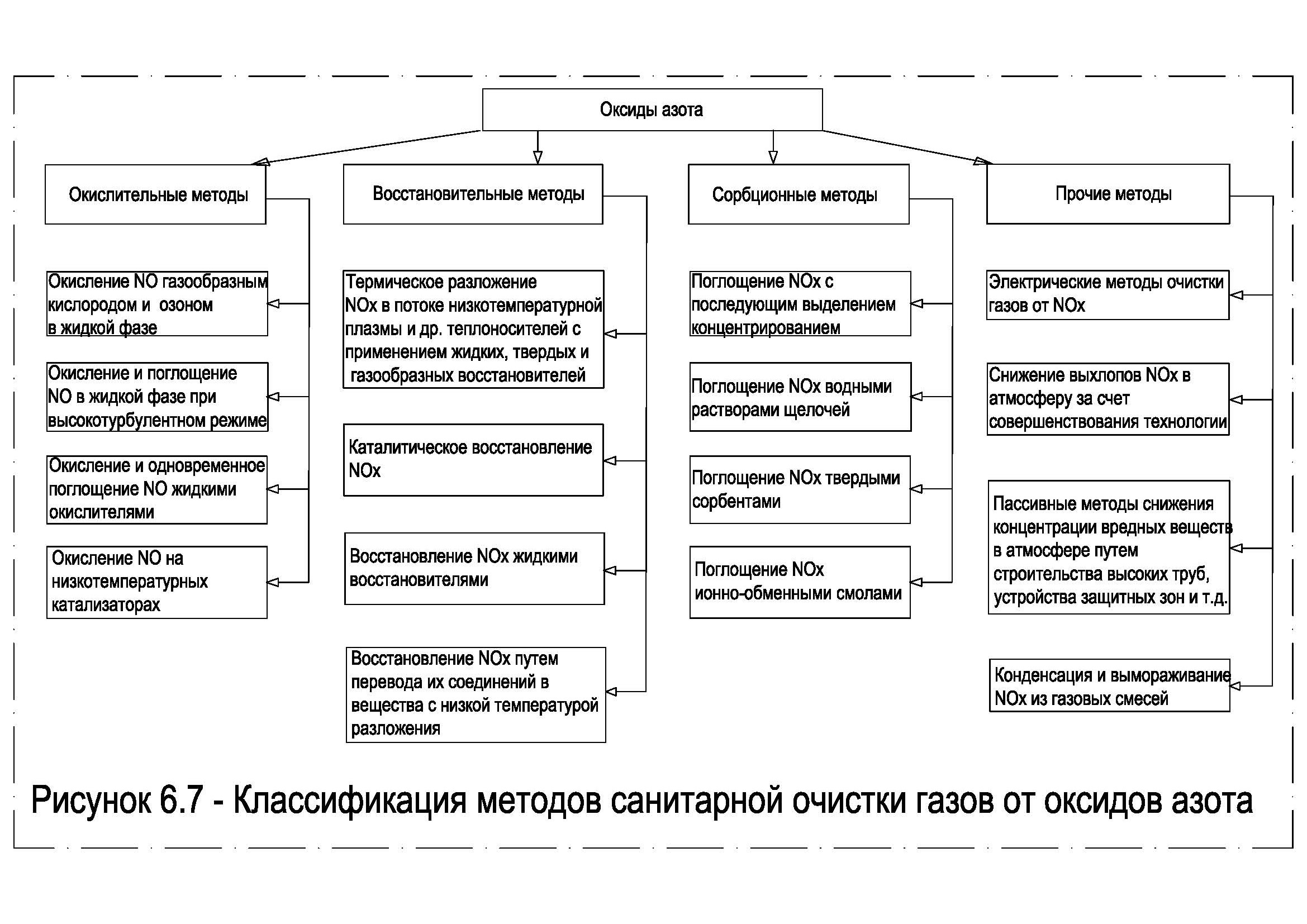
Рисунок 6.7 – Классификация методов санитарной очистки газов от оксидов азота
увеличивается. Каталитическая активность начинает проявляться при температуре 20 °С и достигает максимума при 120 °С.
Каталитическое восстановление оксидов азота. Восстановительные методы санитарной очистки газов основаны на восстановлении NOx до нейтральных продуктов в присутствии катализаторов или без катализаторов под действием высоких температур в присутствии твердых, жидких или газообразных восстановителей. Полное разложение NO2 на NO и О2 наступает при температуре около 600 °С, плное разложеие NO на элементы наступает при температурах 6000-10000 °С, основная часть NOx разлагается при температурах 1500-2000 °С. Для обезвреживания отходящих газов от NOx применяются следующие методы каталитического восстановления:
– высокотемпературное каталитическое разложение;
– селективное каталитическое восстановление;
– разложение гетерогенными восстановителями.
Высокотемпературное каталитическое восстановление. Наиболее эффективным способом обезвреживания нитрозных газов является каталитическое восстановление NOx. Процесс восстановления NOx протекает на поверхности катализаторов в присутствии газа-восстановителя[3, с. 56]. Эффективность процесса каталитического восстановления NOx определяется активностью используемого катализатора. Высокой каталитической активностью обладают катализаторы на основе платины, родия и палладия, менее активны дешевые сплавы, содержащие никель, хром, медь, цинк, ванадий, цезий и др.
Восстановителями являются: оксид углерода, водород, природный газ, пары керосина, аммиак, нефтяной и коксовый газ, азото-водородная смесь. Примеси сернистых соединений отравляют катализатор.
4 NO + CH4  2 N2 + CO2 + 2 H2O + Q 2 N2 + CO2 + 2 H2O + Q
| (6.22) |
2 NO2 + CH4  N2 + CO2 + 2 H2O + Q N2 + CO2 + 2 H2O + Q
| (6.23) |
или
2NO + 2CO  N2 + 2 CO2 + Q N2 + 2 CO2 + Q
| (6.24) |
2 NO2 + 4CO  N2 + 4 CO2 + Q N2 + 4 CO2 + Q
| (6.25) |
или
2NO + 2 H2  N2 + 2 H2O + Q N2 + 2 H2O + Q
| (6.26) |
2 NO2 + 4 H2  N2 + 4 H2O + Q N2 + 4 H2O + Q
| (6.27) |
Каталитическое восстановление NOx начинается при температуре 149 °С в случае применения водорода в качестве восстановителя, 250 °С – при использовании СО, 339 °С – при использовании метана, 350-450 °С – при использовании природного газа. Выбрасываемые в атмосферу газы имеют обычно температуру 30-35 °С, требуют предварительного подогрева. Подогрев и восстановление NOx происходит путем смешения очищаемых газов с газом-восстановителем и сжиганием полученной смеси над слоем катализатора. Температура в зоне разложения NOx резко увеличивается. Обычно поддерживают температуру порядка 800-900 °С. Температура лимитируется термостойкостью катализатора. Допускаемое сдержание кислорода в газовой смеси: для водорода – 4,4 %, метана – 3,2 %. Прирост температуры на каждый процент вступившего в реакцию кислорода составляет: 130-140 °С для метана, 149 °С для водорода. Используется рекуперация тепла в котле-утилизаторе или газовой турбине.
Экономическая целесообразность процесса каталитического восстановления NOx в основном зависит от природы применяемого газа-восстановителя. Предпочтительно использовать водород, т.к. он дает более низкую первоначальную температуру и более полное восстановление NOx. На практике выгоднее использовать природный газ из-за дешевизны и доступности. Недостатком природного газа является повышенная температура начала реакции (350-450 °С) и высокое содержание СО в отходящих газах.
Для этого способа очистки также имеет большое значение выбор носителя катализатора, который определяет механическую прочность, термостойкость, гидравлическое сопротивление, активность катализатора, технологические параметры и его технологичность.
Катализаторы с носителями в виде насыпных шариков из оксида алюминия, керамических шариков работают 1-5 лет. Объемная скорость процесса – 3-6 тыс.ч-1; при начальной концентрации NOx0,3-0,5 % остаточное содержание составляет 5-10-3, 5-10-4, 10-4 % в зависимости от газа-носителя.
Импортные катализаторы с носителями в виде гофрированных лент из хромоникелевого сплава (80 % Niи 20 % Cr) с нанесением на них платины допускают объемную скорость до 120 тыс.ч-1, имеют высокую теплопроводность и небольшой удельный вес.
Наиболее эффективными катализаторами являются импортные керамические катализаторы, выполненные в форме сот, которые обладают повышенной термостойкостью, малым гидравлическим сопротивлением, большой удельной поверхностью, допустимой объемной скоростью до 10 ∙ 105 ч-1.
Метод восстановительной каталитической очистки газов от NOx под давлением 1-8 атм широко используется за рубежом. Аппараты выполнены различной конструкции в зависимости от заданных температур, содержания кислорода и оксидов азота в очищаемом газе, вида топлива.
В нашей стране применение каталитического метода восстановления NOx осуществляется в основном в технологии получения азотной кислоты на отечественных насыпных катализаторах АПК-2. Первая установка была запущена в 1960 г на Кемеровском азотно-туковом заводе. Газ, нагретый до 3 °С, из цехового коллектора хвостовых газов проходит в подогреватель хвостовых газов, где за счет рекуперации тепла отходящих газов нагревается до 360-420 °С, смешивается с очищаемым газом и поступает в реактор. В реакторе установлена корзина с катализатором. Температура газовой смеси за счет тепла реакции повышается до 800 °С. После реактора газ содержит 0,005 % оксида азота и 0,2-0,5 % оксида углерода. Далее газ поступает на очистку от СО.
К недостаткам метода следует отнести высокую стоимость и дефицитность используемых катализаторов; ограничения по содержанию в отходящих газах NOx (не более 0,5 %), кислорода (не более 4-5 %), соединений серы (не должны присутствовать).
Селективное каталитическое восстановление.Этот процесс выгодно отличается от высокотемпературного тем, что протекает избирательно: используемый восстановитель (аммиак) реагирует преимущественно с NOx и почти не взаимодействует с находящимися в нитрозных газах кислородом, в связи с чем его расходуют в количествах, эквивалентных содержанию в обеззараживаемых газах оксидов азота или превышающих стехиометрию на 10-50 % с целью более полного протекания следующих экзотермических реакций:
6NO + 4 NH3  5 N2 + 6 H2O 5 N2 + 6 H2O
| (6.28) |
6 NO2 + 8 NH3  7 N2 + 12 H2O 7 N2 + 12 H2O
| (6.29) |
8NO + 2 NH3  5 N2O + 3 H2O 5 N2O + 3 H2O
| (6.30) |
5 NO2 + 2 NH3  7 NO + 3 H2O 7 NO + 3 H2O
| (6.31) |
Безвредные продукты реакции (азот и вода) являются еще одним выгодным отличием этого метода. Присутствие кислорода в отходящих газах благоприятствует реализации каталитического восстановления, реакции ускоряются, и процесс идет следующим образом:
4NO + 4 NH3 + O2  4 N2 + 6 H2O 4 N2 + 6 H2O
| (6.32) |
Селективное каталитическое восставновление происходит при низких температурах (180-360 °С) с выделением небольшого количества тепла. Температура очищаемых газов увеличивается в зоне катализа на 10-20 °С. При избытке аммиака его основное количество окисляется присутствующим в нитрозных газах кислородом по экзотермической реакции:
4 NH3 + 3 O2  2N2 + 6 H2O 2N2 + 6 H2O
| (6.33) |
Процесс достаточно прост по аппаратурному оформлению и внедрен в производствах азотной кислоты под давлением 0,35 МПа. Отходящие нитрозные газы таких производств содержат до 0,2 % (об.) NO + NO2. Технологическая схема процесса представлена на рисунке 6.8.
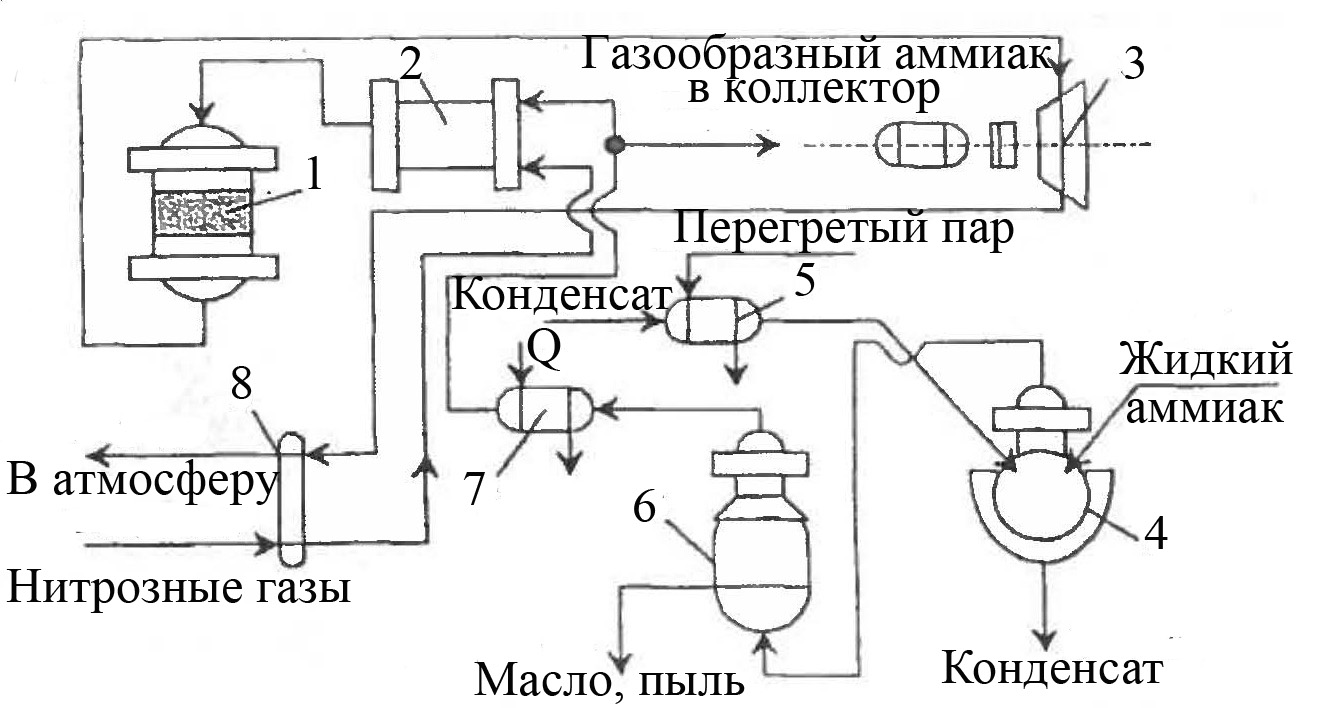
1 – реактор; 2 – смеситель; 3 – рекуперационная турбина; 4 – испаритель; 5, 7, 8 – подогреватели; 6 – фильтр
Рисунок 6.8 – Схема установки каталитической очистки отходящих нитрозных газов производств азотной кислоты под давлением 0,35 МПа
Нитрозные газы при 20-30 °С подают в подогреватель, где их нагревают до 240-280 °С и направляют в смеситель. Подаваемый в установку жидкий аммиак испаряют нагретым конденсатом. Образующиеся пары аммиака при давлении 3,5-10,0 Па очищают в фильтре, нагревают до 120 °С и смешивают с нагретыми нитрозными газами, регулируя соотношение NH3 : NOx на уровне (1,2-1,3):1. Полученную смесь направляют в реактор, где на алюмо-ванадиевом катализаторе АВК-10 идет восстановление оксидов азота аммиаком. Обезвреженные нитрозные газы при 300 °С из реактора подают на рекуперационную
турбину, откуда их направляют в подогреватель, после которого при 150-170 °С выбрасывают в атмосферу. При возможном образовании в системе аммонийных солей предусматривают периодическую остановку и пропаривание турбины насыщенным паром низкого давления.
Процесс обеспечивает обезвреживание нитрозных газов на 96 %. Содержание суммы NOи NO2 в обеззараженных газах не превышает 0,01 % (об.), NH3 – до 0,015 % (об.).
В качестве эффективных катализаторов при восстановлении нитрозных газов (содержащих 1-30 %NOх) аммиаком могут быть использованы цеолиты. Адсорбция на них NH3и NOx ускоряет их взаимодействие, обеспечивая при 330-480 °С высокую эффективность процесса обезвреживания оксидов азота.
Процесс очистки газов, при котором NOxпревращается в элементарный азот посредством введения аммиака, получил широкое распространение. Как пример можно привести технологию DENOXдатской фирмы «HALDORTOPSOEA/S». Процесс используется для очистки отходящих нитрозных газов тепловых электростанций и котельных, химических предприятий, мусоросжигательных заводов, газовых турбин, дизельных моторов и генераторов.
Наилучшим образом процесс DENOX зарекомендовал себя для очистки дымовых газов тепловых (мазутных) электростанций, где, как известно, имеют место значительные выбросы сажи.
Катализатор сотовый, тспользуемый в процессе, не забивается пылью, имеет низкое аэродинамическое сопротивление, срок службы катализатора до дезактивации – 4-5 лет, верхний слой катализатора меняется через 10 лет. Катализатор обеспечивает восстановление 90 %NOx в диапазоне температур 320-340 °С при объеме газа от 10 до 800 тыс.нм3/ч, концентрации оксидов азота в газе 0,04-0,09 %.
Принципиальная технологическая схема процесса DENOX представлена на рисунке 6.9.Жидкий аммиак из резервуара (3) подается в испаритель (4), откуда пары аммиака, смешиваясь с воздухом высокого (3-5 бар) давления, поступают в поток очищаемого газа через сопловый смеситель (2), обеспечивающий равномерное распределение аммиака в сечении газового потока, и далее – в реактор. Реактор имеет прямоугольное сечение, содержит 2 или более слоев катализатора, между которыми при необходимости располагают пароструйные воздуходувки (5) для улавливания пыли и летучей золы с поверхности катализатора. Внешний вид установки DENOX-процесса датской фирмы «HALDORTOPSOEA/S» представлен на рисунке 6.10.
Таким образом, процессы селективного каталитического восстановления оксидов азота используют для обработки нитрозных газов, содержащих пыль, сажу, диоксид серы и могут применять для очистки газовых выбросов в черной металлургии.
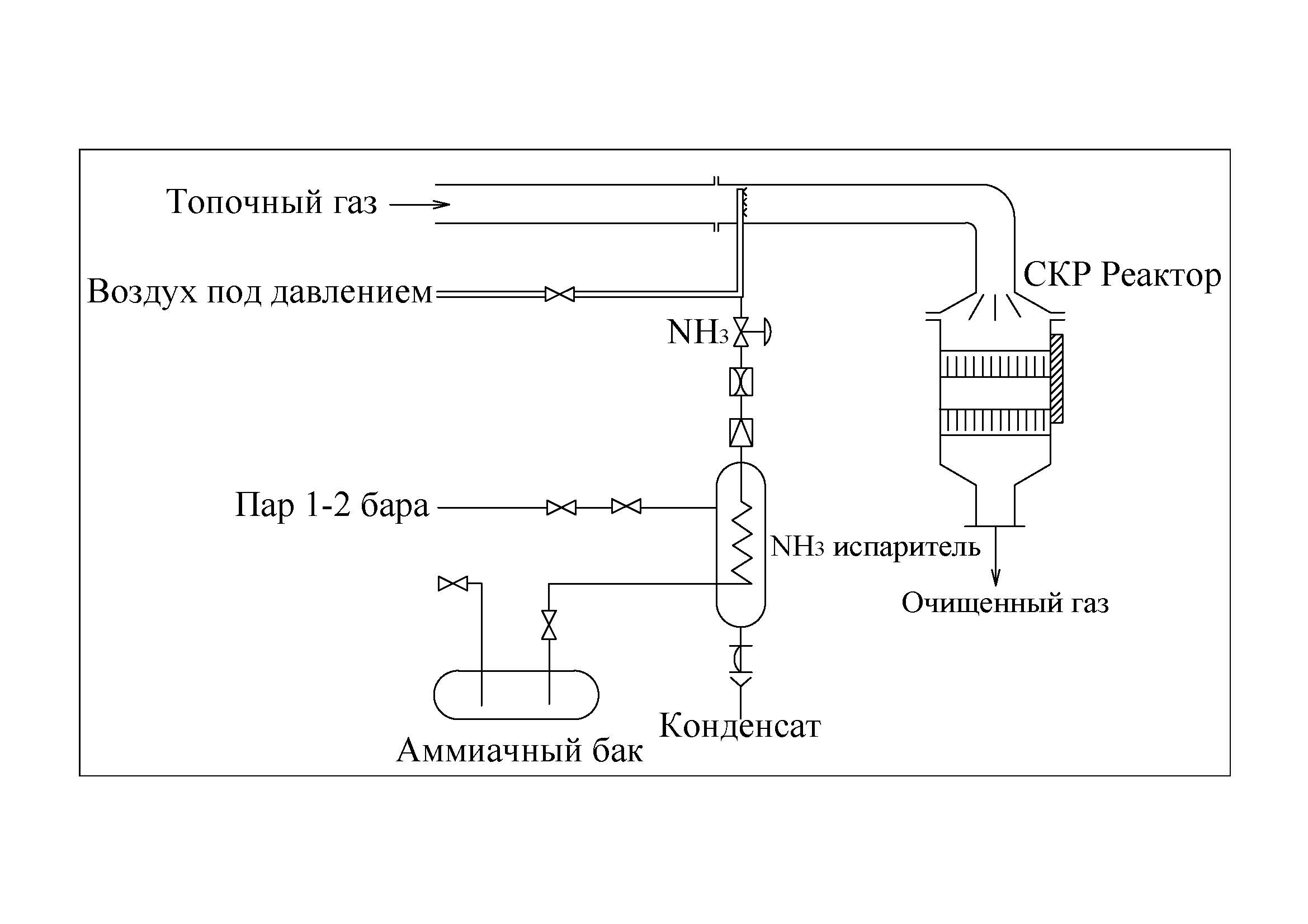
1 – реактор; 2 – смеситель; 3 – емкость аммиака; 4 – испаритель аммиака; 5 – пароструйные воздуходувки
Рисунок 6.9 – Схема установки каталитической очистки топочных газов в процессе ДЕНОКС

Рисунок 6.10 – Внешний вид установки ДЕНОКС
Разложение оксидов азота гетерогенным восстановлением.При высоких температурах (500-1300 °С) разложение азота в отходящих газах может быть проведено на твердых углеродсодержащих материалах: угле, коксе, графите. В таких процессах углерод выполняет функции как катализатора, так и топлива. Каталитическое действие углерода связано с образованием комплексов углерод-кислород:
С + NO  (C-O) + ½ N2 (C-O) + ½ N2
| (6.34) |
(C-O)NO  CO2 + ½ N2 CO2 + ½ N2
| (6.35) |
Имеет место быстрая потеря активности таких катализаторов. С целью увеличения активности катализаторов и степени разложения NOx вводят в углеродистый материал карбонат натрия. С увеличением температуры скорость процесса восстановления возрастает: при 800 °С степень восстановления NOx на коксе достигает 96 %; при 1000 °С – 100 %. Высокие температуры отрицательно сказываются на технико-экономических показателях процесса.
Сорбционные методы очистки от оксидов азота. Определенное распространение (в основном за рубежом) получили сухие сорбционные (и хемосорбционные) способы денитрификации отходящих газов. В качестве сорбентов используются активированные угли, БПК, γ-Al2O3, торфощелочные реагенты и др. Эффективность этих методов – 70-90 %, температура процесса – 80-130 °С.
Хемосорбционные методы часто применяются для совместной очистки газов от SO2 и NOx, что является их преимуществом. Недостаток – дороговизна применяемых сорбентов. При применении относительно дешевых сорбентов (БПК из углей канско-ачинского бассейна, коксолигнин) данные методы вполне перспективны для очистки дымовых газов.
Мокрые абсорбционные методы очистки газов от оксидов азота применяются сравнительно редко, хотя их преимуществом является довольно высокая эффективность (до 90-97 %) и рекуперативность (в отличие от каталитических). Для успешного поглощения растворителем NO должен быть окислен до NO2 с использованием активных окислителей (озон, H2O2, KMnO4, KBrO3, K2Cr2O7и др.).
NO + H2O2  NO2 + H2O NO2 + H2O
| (6.36) |
3 NO2+ H2O  2 HNO3 + NO 2 HNO3 + NO
| (6.37) |
или
2 NO2 + Na2CO3  NaNO3 + NaNO2 + CO2 NaNO3 + NaNO2 + CO2
| (6.38) |
Представляют интерес селективные жидкие сорбенты NOx, в частности раствор FeSO4 (в качестве такого раствора могут быть использованы отработанные травильные растворы метизного производства).
Более перспективно применение хемосорбционных и каталитических процессов совместной очистки газов от SO2и NOx. В последнее время прошли промышленную проверку и считаются наиболее перспективными методы совместного окисления SO2и NOx, инициированного излучением высоких энергий или сильными окислителями (электронно-лучевой и озонный методы). Основное их преимущество – рекуперативность (получение на основе SO2и NOx ценных побочных продуктов – сульфата, нитрата аммония и др.).
Эффективность электронно-лучевого способа (США, Япония) по SO2 – 8-95 %; по NOx – 70-90 %.Эффективность озонного способа (США, ФРГ) по SO2 – до 95 % (отечественные данные – до 80 %) и по NOx – до 90 % (отечественные данные –60%). Внедрение этих методов считается весьма перспективным, однако сдерживается отсутствием ускорителей большой единичной мощности и высокочастотных озонаторов.
Прочие методы очистки примесей отходящих газов цветной металлургии. К числу наиболее вредных примесей отходящих газов ЦМ относятся SO2, Cl2, HFи HCl. В практике очистки газов от фтористых и хлористых соединений чаще применяются абсорбционные и реже адсорбционные методы. Для абсорбции фтористых соединений (в частности, HF) используют воду, водные растворы щелочей, солей и некоторые суспензии (Na2CO3, NH4OH, Ca(OH)2 и др.). В алюминиевом производстве очистку от HF осуществляют в скрубберах различных конструкций, орошаемых 5 %-ым раствором Na2CO3. Степень очистки от HF достигает 97-98 %. Используется также известковое молоко (эффективность 88-90 %), растворы аммонийных солей.
Из твердых хемосорбентов HF эффективны известняк, фторид натрия, ионообменные материалы и т.д. Наиболее перспективно применение для поглощения HF глинозема с последующим его использованием в самом алюминиевом производстве. Для этих целей используются как аппараты с псевдоожиженным слоем Al2O3, так и рукавные фильтры с нанесенным слоем глинозема.
Отходящие газы, содержащие одновременно Cl2 и HCl, подвергаются мокрой очистки очистке в скрубберах(1-я ступень – очистка водой с получением 10-18 %-ной HCl, а 2-я ступень – очистка от Cl2 при помощи известкового молока). Более эффективно применение для поглощения Cl2Na2CO3, а также CCl4, TiCl4. Из твердых сорбентов Cl2 хорошо себя зарекомендовал лигнин и лигносульфонат Ca (отходы лесохимии). Для поглощения HCl используются сульфаты и фосфаты Cu, цеолиты и некоторые промышленные отходы (доменные и сталеплавильные шлаки и шламы, оксиды щелочных и щелочноземельных металлов и др.).
1.
Дата добавления: 2017-01-26; просмотров: 16020;











