Электронное строение фенола и его производных









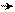
 ׃О – Н ОН+ ОН+ ОН+
׃О – Н ОН+ ОН+ ОН+












 δ– δ–
δ– δ–
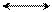
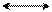
 δ+ δ+
δ+ δ+

 δ–
δ–
мезо-формула фенола граничные или предельные структуры фенола
(– I, + M (p-π) сопряжение)
Фенол имеет гидроксогруппу, обладающую отрицательным индуктивным эффектом, который намного меньше, чем у галогенов, и большим положительным мезомерным эффектом в виде p-π-сопряжения. В результате сложения этих эффектов, где индуктивным можно пренебречь, ядро обогащается π-электронной плотностью, локализуя частично отрицательные заряды в о- и п-положениях бензольного ядра. Активность этих положений по отношению к электрофилам можно видеть в граничных формулах фенола.Таким образом, реакции замещениея электрофильного характера у фенола идут легко, где электрофилы будут занимать о- и п-положения в ядре относительно гидроксогруппы.
С другой стороны, в результате p-π-сопряжения атом водорода в гидроксильной группе становится подвижным, поэтому фенол выступает как кислота («карболка»):

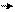

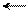 ׃Оδ– Нδ+ О–
׃Оδ– Нδ+ О–
 |  |

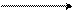 Н+ +
Н+ +
фенол фенолят-ион
Кислотность фенола больше, чем у спирта. Константа ионизации у спирта небольшая (Ка ≈ 10–18), тогда как у фенола эта величина значительно больше (Ка = 1,3 •10–10).
Большая кислотность фенолов по сравнению со спиртами объясняется образованием фенолят-иона, который более устойчив, чем фенол, за счет делокализации отрицательного заряда (полный заряд у гетероатома всегда более подвижен, чем неподеленная пара электронов и, следовательно, лучше вступает в сопряжение):






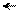
 О– О О О
О– О О О













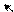 | |||||||||||||||
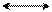 | 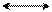 | ||||||||||||||
 |  |  |  |  | |||||||||||

мезо-формула фенолят-иона граничные формулы фенолят-иона
В то же время константа ионизации у фенола меньше, чем у угольной и других карбоновых кислот, например, константа ионизации угольной кислоты равна 10–7 (Ка = 4,9 •10–7), а уксусной кислоты – 10–5 (Ка = 1,8 •10–5). Для сравнения константа ионизации у воды равна 10–16 (Ка = 1,8 •10–16).
Поэтому фенолы реагируют с растворами щелочей и образуют феноляты:
 C6H5 – OH + NaOH C6H5 – ONa + H2O
C6H5 – OH + NaOH C6H5 – ONa + H2O
фенол фенолят натрия
Однако угольная кислота вытесняет фенол из фенолятов как более сильная кислота, причем в качестве неорганического продукта реакции образуется кислая соль угольной кислоты, а не средняя соль, так как кислая соль (бикарбонат) имеет меньшую константу ионизации, чем фенол и сама угольная кислота (реакция идет в сторону образования менее диссоциирующих веществ, что энергетически выгодно):
 C6H5 – ONa + H2СO3 C6H5 – OH + NaНСО3
C6H5 – ONa + H2СO3 C6H5 – OH + NaНСО3
фенолят натрия фенол бикарбонат натрия

 К (Н2СО3) ≈ 10–7 (Н2СО3Н+ + НСО3– );
К (Н2СО3) ≈ 10–7 (Н2СО3Н+ + НСО3– );
 К (НСО3– ) ≈ 10–11 (НСО3– Н+ + СО32– ).
К (НСО3– ) ≈ 10–11 (НСО3– Н+ + СО32– ).
Эти реакции используют для разделения фенолов и спиртов или карбоновых кислот.
Это объяснение не относится к фенолам, содержащим электроноакцепторные группы в ядре (заместители 2-ого рода), которые увеличивают подвижность атома водорода в НО-группе фенола (электронные эффекты фенола и этих групп, находящихся в системе сопряжения, действуют в одном направлении, усиливая подвижность протона).
Например:




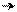


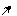
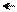

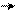


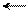
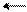


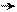 ׃О Н ׃O H ׃О Н ׃О Н
׃О Н ׃O H ׃О Н ׃О Н
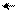
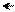
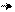


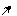



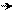
 NO2 O2N NO2
NO2 O2N NO2
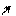 | |||||||
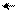 | 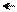 | ||||||
 | |||||||
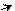

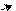
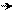
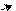



NO2
NO2 NO2
о-нитрофенол п-нитрофенол м-нитрофенол симметричный
тринитрофенол
(пикриновая кислота)
Ка (о-нитрофенола) = 6,8•10–8 (нитрогруппа находится в системе сопряжения);
Ка (п-нитрофенола) = 6,5•10–8 (нитрогруппа находится в системе сопряжения);
Ка (м-нитрофенола) = 5,3•10–9 (нитрогруппа не находится в системе сопряжения);
Ка (пикриновая кислота) = 4,2•10–1(все три нитрогруппы находятся в системе сопряжения).
В соединении 2,4,6-тринитрофеноле три нитрогруппы настолько сильно оттягивают к себе электронную плотность из кольца, что поляризация связи Н – О в фенольном гидроксиле увеличивается, делая подвижным атом водорода настолько, что соединение приобретает свойства кислоты, откуда и получила название пикриновой кислоты.
Заместители 1-ого рода уменьшают подвижность атома водорода в НО-группе фенола, поскольку электронные эффекты фенола и заместителей в кольце действуют в противоположных направлениях, препятствуя отрыву протона.

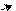




 Например: ׃О Н
Например: ׃О Н
Ка (п-метилфенола) = 6,7•10–11

СН3
п-метилфенол
Дата добавления: 2017-01-16; просмотров: 3300;











