Структурно-функциональная организация и биогенез микро-РНК, коротких интерферирующих РНК и других малых РНК
В класс малых РНК включают молекулы, содержащие от 20 до 300 нуклеотидов. За эффект РНК-интерференции отвечают самые короткие из них – siRNA, состоящие всего из 21–28 (у млекопитающих из 21–23) нуклеотидов (таблица 3). Особенность этих молекул проявляется в том, что они в отличие от большинства других клеточных РНК, состоящих всего из одной цепи нуклеотидов, являются двунитчатыми. Нуклеотиды с противоположных нитей (цепей) siRNA спариваются по тем же законам комплементарности, которые формируют двунитчатые цепи ДНК в хромосомах. Кроме того, по краям каждой из цепей siRNA всегда остаются два неспаренных нуклеотида.
Происхождение двухцепочечных РНК в клетке может быть различным: транскрипция с конаправленных промоторов, активность клеточной или вирусной РНК-зависимой РНК-полимеразы, самокомплементарные транскрипты, способные к внутримолекулярному спариванию и образованию шпилечных структур, а также искусственно введенные в клетку молекулы.
Механизм РНК-интерференции очень древний. Скорее всего, биологическая эволюция создала его более миллиарда лет назад, когда нашу планету населяли только микроорганизмы. С его помощью они получили возможность защищаться от нападений вирусов. Позже эту способность переняли у них грибки и растения, а потом и животные. Многоклеточные организмы также научились прицельно отключать с помощью РНК-интерференции собственные гены, прерывая процесс синтеза кодируемых ими белков.
Таблица 3 – Основные типы малых РНК и их свойства
| Класс | Подкласс | Длина (в нуклеотидах) | Биогенез | Механизм действия | Биологическая функция |
| Микро РНК (miRNA) | Нет | ~22(19–25) | Двухстадийное разре-зание предшествен-ников шпилечных структур ферментами Drosha и Dicer | Репрессия транс-ляции, разрезание мРНК | Различные (часто дейст-вуют в процессе развития и клеточной дифференцировки) |
| К ороткая ин-терферирую-щая РНК (siRNAs) | Эндогенная взаимодей-ствующая siRNA | 21–22 (у не-матоды) 21 (у расте-ний) | Разрезание длинных эндогенных dsRNAs с помощью Dicer | Разрезание мРНК | Неизвестна |
| Ассоцииро-ванная с повторами siRNA (rasiRNA) | 24–24 (у растений) 24–27 (у плодовой мушки) | Разрезание длинных dsRNAs, происходящих от повторяющихся последовательностей, ферментом Dicer | Модификация гис-тона и/или ДНК | Сайленсинг транспозонов, повторяющихся генов и вирусов | |
| Малая ска-нирующая РНК (scnRNA) | ~28 | Разрезание длинных dsRNAs с помощью Dicer | Метилирование гистонов, ведущее к элиминации ДНК | Перестройка генома в ходе конъюгации | |
| Крошечная некодирую-щая РНК (tncRNA) | Нет | ~20 | Производится ферме-том Dicer из неиз-вестного предшественника | Неизвестен | Неизвестна |
| Малая моду-ляторная РНК (smRNA) | Нет | ~20 | Неизвестен | Транскрипционная трансактивация | Дифференциация нейро-нов |
На рисунке 6 схематически показан механизм работы siRNA в клетках растений и животных. Первые 4 этапа являются общими для всех организмов. Сначала с молекулой siRNA связываются белки-ферменты хеликаза и нуклеаза (см. этап 1), формируя комплекс RISC (RNA-induced silencing complex; silence– англ. молчать, замолкать; silencing – замолкание, так в англоязычной и специальной литературе называют процесс "выключения" гена).
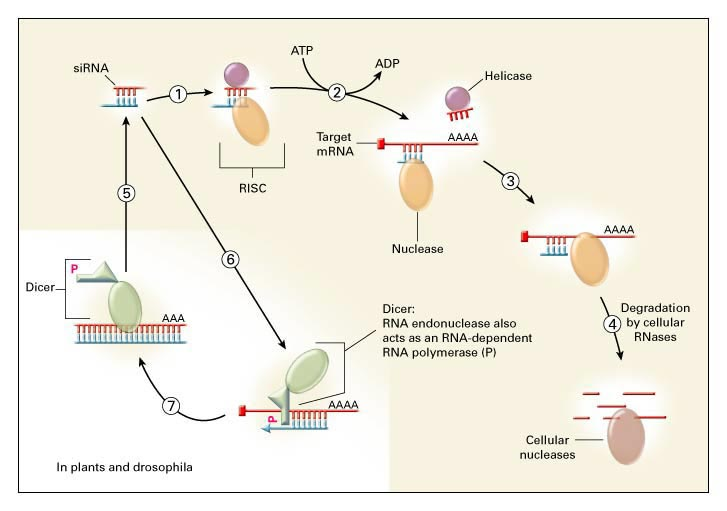
Рисунок 6 – Механизм работы siRNA в клетках растений и животных
Хеликаза раскручивает нити siRNA, в результате чего они расходятся (этап 2). Одна из нитей, к которой прикреплен фермент нуклеаза, – ее официальное название аргонавт (argonaute), может теперь связаться с комплементарным (строго соответствующим ей) участком однонитчатой мРНК (этап 3), позволяя нуклеазе разрезать ее. Разрезанные же участки мРНК подвергаются действию других клеточных РНКаз, которые разрезают их на более мелкие куски (этап 4).
У растений и насекомых выработалась своеобразная система усиления защитного действия siRNA (этапы 5–7). Присоединяясь к цепи мРНК, участок siRNA может с помощью комплекса ферментов, называемого DICER, сначала достроить вторую цепочку мРНК, а затем разрезать ее в разных местах, создавая таким образом разнообразные "вторичные" siRNA. Они в свою очередь формируют RISC и проводят мРНК через все стадии, о которых шла речь выше, вплоть до ее полного уничтожения. Такие "вторичные" молекулы смогут специфично связываться не только с тем участком вирусной мРНК, к которому была направлена "первичная" молекула, но также и с другими участками, что резко усиливает эффективность клеточной защиты.
У млекопитающих в отличие от насекомых и растений работает и другая система защиты. При попадании в "зрелую" (дифференцированную) клетку млекопитающего чужой РНК, длина которой больше 30 нуклеотидов, клетка начинает синтез интерферона. Интерферон, связываясь со специфическимирецепторами на клеточной поверхности, способен стимулировать целую группу генов. В результате в клетке синтезируется несколько видов ферментов, которые тормозят синтез белков и расщепляют вирусные РНК. Кроме того, интерферон может действовать и на соседние, еще не зараженные клетки, блокируя тем самым возможное распространение вируса.
Как можно заметить, обе системы во многом схожи. Даже названия "interferon" и "(RNA) interference" происходят от общего корня. Но есть у них и одно очень существенное различие: если интерферон при первых признаках вторжения просто "замораживает" работу клетки, не позволяя (на всякий случай) производство многих белков в клетке, то система siRNA отличается чрезвычайной разборчивостью: каждая siRNA будет распознавать и уничтожать только свою, специфическую мРНК. Замена всего лишь одного нуклеотида внутри siRNA ведет к резкому снижению эффекта интерференции.
3.3 Функциональная роль РНК-интерференции
Итак, мы видим, что основная "специальность" siRNA в клетке – это блокирование генов, участок которых соответствует одной из цепочек внутри siRNA. Но почему механизм РНК-интерференции существует в клетках? Какие процессы он призван регулировать? Что из себя представляют те мРНК, на которые направлено "жало" малых РНК, и почему их необходимо уничтожать?
Одно из возможных объяснений роли РНК-интерференции – это защита организмов от РНК-содержащих вирусов и мобильных элементов, перемещающихся посредством РНК. Таким образом, двухцепочеченые РНК (дцРНК) могут быть важными звеньями иммунной системы, распознающими и ликвидирующими чужую РНК. В случае, если в клетку проник РНК-содержащий вирус, такая система защиты не даст ему размножиться. Если же вирус содержит ДНК, дцРНК будет мешать ему производить вирусные белки.
Как предполагают, роль коротких РНК в клетке не ограничивается только защитой от вирусов и других чужеродных РНК. Дело в том, что геном любого многоклеточного организма включает множество элементов, которые когда-то были привнесены в него в процессе эволюции извне, например как результат встраивания вируса. Из всего материала, содержащегося в хромосомах человека, 34% приходится на долю элементов, называемых LINEs и SINEs(соответственно, Long и Short Interspersed Nuclear Elements), о функциях которых известно только то, что они могут время от времени копировать себя и перемещаться с одного места хромосомы на другое. Те участки ДНК, которые достались нам от ретровирусов (8% генома) и транспозоны (3%) также способны менять свое место в геноме. LINEs, SINEs, остатки вирусной ДНК и транспозоны, за их способность к перемещениям названные подвижными, илимобильными, элементами генома, представляют значительную опасность для наших хромосом. Некоторые из них – остатки вирусов, или протоонкогены – способны при "включении" вызывать рак, другие мобильные элементы, размножаясь и перемещаясь, меняют структуру хромосом, что может привести к мутациям.
Например, у плодовой мушки дрозофилы более 80% спонтанных мутаций возникают именно из-за "хулиганского" поведения ее собственных мобильных элементов. Их перемещения внутри генома так индивидуальны и непредсказуемы, что положение некоторых из них может служить "молекулярным паспортом", точно определяющим личность хозяина, что уже используется на практике. Понятно, что каждому организму было необходимо разработать систему жесткого контроля за поведением мобильных элементов. Как раз эту "надзирательскую" функцию, как полагают, и выполняет система внутриклеточных siRNA. На модели все того же C. elegans, например, было показано, что отключение генов, кодирующих некоторые из малых РНК, ведет к активизации перемещений мобильных элементов в его хромосомах и соответственно – к повышению уровня мутаций.
Кроме того, ошибки в развитии органов и тканей при отключении генов, кодирующих систему siRNA у подопытных животных, а также ее активность в "незрелых" клетках указывают на то, что механизм РНК-интерференции активно участвует в регуляции программы "созревания" клеток и как следствие может играть одну из ключевых ролей в формировании целостного организма.
Еще одна из предполагаемых нормальных функций siRNA – отслеживание неправильно обработанных копий других типов РНК в клетке.
Наконец, в 2002 г. исследователи неожиданно выяснили, что действие siRNA может не ограничиваться лишь временным выключением генов на уровне РНК. Имеются показания, что в некоторых случаях siRNA, видимо, воздействует прямо на ДНК, изменяя структуру хроматина и способствуя длительному "замолканию" одних и, возможно, активизации других генов.
3.4 Использование явления РНК-интерференции и малых РНК в функциональной геномике и экспериментальной генотерапии
Этот защитный механизм, предохраняющий клетку от вирусов и мобильных генетических элементов, можно использовать в терапевтических целях. Самое главное для практического применения РНК-интерференции – то, что для фермента аргонавта не имеет значения, какую информационную РНК уничтожать: он слепо следует указаниям микро-РНК.
Обычно лекарства действуют на уровне конечных стадий биохимического «производства»; они, образно говоря, «выключают» (или «ломают») работающие «станки» или уничтожают «готовые изделия». Открытие РНК-интерференции делает возможной применение иной стратегии: не обезвреживать нежелательный биохимический продукт (рискуя нарушить заодно и какой-либо нормально протекающий процесс), а просто "нацеливать" собственный защитный механизм клетки – RISC – на определенную информационную РНК, предотвращая таким способом образование нежелательного продукта. Достаточно сконструировать правильную микро-РНК. Это на современном этапе вполне выполнимая задача, поскольку геном человека уже секвенирован, а для некоторых болезней известны вполне определенные гены, за них ответственные. Ныне уже разработан метод РНК-интерференции, который предполагает внесение в клетку дцРНК, специально сконструированной под определенный ген.
Недавние эксперименты на животных показали, что с помощью дцРНК можно погасить ген, обусловливающий, например, высокий уровень холестерина в крови; есть надежда использовать в перспективе РНК-интереференцию для лечения вирусных инфекций, в том числе СПИДа, рака и обменных нарушений. Высокая специфичность и эффективность siRNA-методов в совокупности с их низкой токсичностью вселяют оптимизм.
Вот примеры из офтальмологии: новые подходы к лечению макулярной дегенерации сетчатки (macular degeneration) – болезни, которая приводит к потере зрения. Ежегодно в мире регистрируется полмиллиона новых случаев этого заболевания. Болезнь заключается в том, что в центральной части сетчатки неконтролированно растут новые кровеносные сосуды, что приводит к разрушению светочувствительных нервных клеток.
Филадельфийская компания Acuity Pharmaceuticals проводит клинические испытания экспериментального метода лечения макулярной дегенерации сетчатки с помощью РНК-интерференции. Больному непосредственно в глаз вводят короткие фрагменты рибонуклеиновой кислоты, которые заглушают ген, обусловливающий аномальное разрастание капилляров.
Американская фармацевтическая фирма Sirna начала клинические испытания первого лекарства, механизм действия которого основан на РНК-интерференции (пока оно называется «Sirna-027»). «Sirna-027» – это специфическая микро-РНК, которая запускает механизм разрушения информационной РНК, обеспечивающей синтез рецептора фактора роста эндотелия сосудов. Для терапевтического применения микро-РНК химически модифицирована особым образом, поскольку «обычные» РНК, введенные в организм, плохо проникают в клетки и быстро разрушаются.
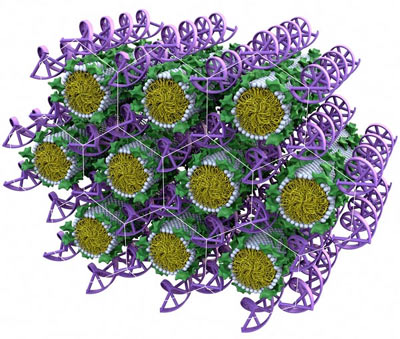
Рисунок 7 – Одна из искусственных молекулярных конструкций для доставки генетического материала в клетку, разработанная в Калифорнийском университете в Санта-Барбаре. Водоотталкивающие шарообразные липидные молекулы связываются с окаймляющими их молекулами ДНК или РНК в единый комплекс
Сегодня, кроме макулярной дегенерации сетчатки, фирма «Sirna» выполняет программы (пока на доклинических стадиях) по раку, гепатитам В и С, диабету, астме, болезни Хантингтона (прогрессирующая дегенерация нервных клеток, приводящая к инвалидности) и облысению (это пока тоже неизлечимое явление). Главная проблема в области клинического применения микро-РНК – не конструирование самих молекул, специфических для определенных генов-мишеней, а их доставка в клетку (рисунок 7). В отличие от многих обычных лекарств молекулы РНК сравнительно большие и обладают физико-химическими свойствами, которые мешают им проходить через внешнюю мембрану клетки.
Решением этой проблемы занимается целая отрасль современной науки (drug delivery). Применяются две стратегии: во-первых, использование «готовых» систем доставки РНК или ДНК в клетку, получаемых из некоторых вирусов, а во-вторых, создание искусственных конструкций из молекул (например, липосом).
Теперь – о лечении СПИДа. Если удастся тем или иным способом доставить siRNA, обладающую способностью связываться с каким-либо участком РНК-генома ВИЧ, можно попытаться не допустить его встраивания в ДНК клетки хозяина. Можно также воздействовать на различные этапы размножения ВИЧ в уже зараженной клетке. Последний подход не обеспечит излечения, однако существенно уменьшает скорость размножения вируса и дает иммунной системе больного шанс "отдохнуть" от вирусной атаки и самой попытаться расправиться с остатками заболевания.
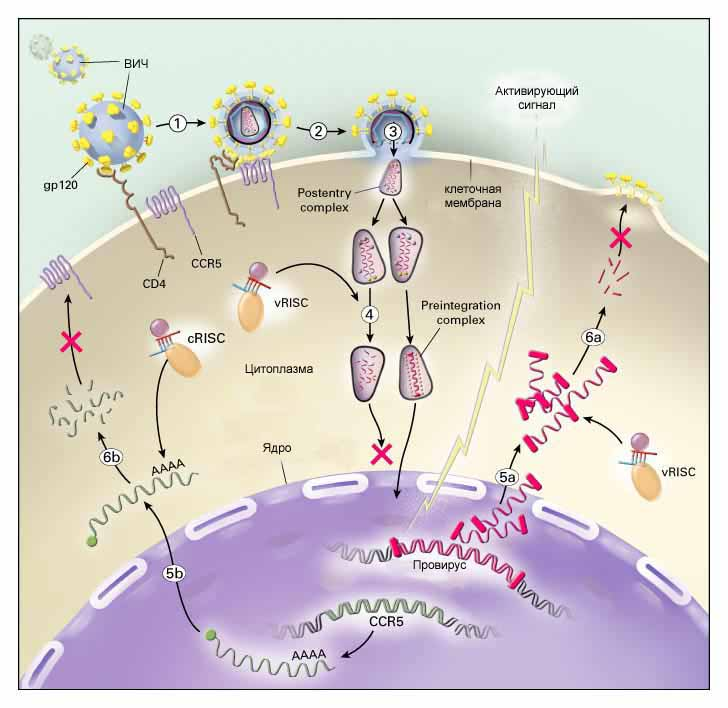
Рисунок 8 – Этапы развития ВИЧ
На рисунке 8 крестиками отмечены те два этапа размножения ВИЧ в клетке, которые, как надеются, можно заблокировать с помощью siRNA (этапы 4–5 – встраивания вируса в хромосому – и этапы 5–6 – сборка вируса и выход из клетки).
Сегодня, правда, эта возможность относится, скорее, к области теории. На практике терапия siRNA встречается с затруднениями. Например, в случае антивирусной терапии именно высокая специфичность siRNA может сыграть злую шутку: вирусы обладают способностью быстро мутировать, т.е. изменять состав своих нуклеотидов. Особенно преуспел в этом ВИЧ, частота изменений которого такова, что у человека, заразившегося одним подтипом вируса, через несколько лет может быть выделен абсолютно непохожий на него подтип. В этом случае измененный штамм ВИЧ автоматически станет нечувствительным к siRNA, подобранной в начале терапии.
Учитывая эти затруднения, предлагаются альтернативные варианты противовирусной siRNA-терапии. В случае ВИЧ, например, показано, что блокирование одной из молекул-рецепторов на клеточной поверхности, необходимых для прикрепления вируса к клетке (CCR5, этап 6b на рисунке 8), также может предотвращать заражение ВИЧ. Преимуществом данного подхода является то, что ген CCR5 и соответственно его мРНК, отличаются (по сравнению с ВИЧ) гораздо большей стабильностью своего состава, а значит, подобрать для нее эффективную siRNA гораздо легче.
РНК-интерференция широко используется также в научных целях в функциональной геномике для анализа функций различных генов. После описания нуклеотидных последовательностей геномов многих животных и человека перед наукой встала очередная глобальная задача: выяснить роль каждого гена. Одним из основных инструментов, применяемых генетиками для решения этого вопроса, является "выключение" гена. Действительно, чтобы хотя бы в первом приближении оценить функцию гена, нужно посмотреть, как поведет себя клетка без него, какие биохимические процессы при этом нарушатся.
Если раньше на поиски удачного способа блокировки гена и приведение его в действие требовалось от нескольких месяцев до года, то с помощью метода siRNA, или генного нокдауна, практически с любым геном любого организма, последовательность нуклеотидов которого известна, эту процедуру можно проделать в 1–2 недели, значительно повысив специфичность блокирования. При этом инъекция двухцепочечных фрагментов РНК, комплементарных участку информационной РНК, возможна на различных этапах клеточного цикла. Например, таким способом было систематически инактивировано 5690 генов C.elegans для определения генов, регулирующих продолжительность жизни.
В Институте цитологии и генетики СО РАН в Новосибирске установлена возможность сиквенс-специфического подавления экспрессии гена-мишени короткой синтетической интерферирующей РНК в головном мозге млекопитающих in vivo. Результаты исследований открывают новые возможности изучения функции генов в центральной нервной системе и применения РНК-интерференции для воздействия на патологические процессы в головном мозге.
Согласно этому, ранее неизвестному механизму стресс, терапия или даже материнская забота низкого качества, изменяющие экспрессию нейрогена в раннем онтогенезе, способны предрасполагать к развитию психопатологии.
Но не все получается так гладко в связи с использованием методов siRNA. Основная проблема состоит в том, что не все гены подвержены РНК-интерференции, а в норме в организме животных дцРНК вообще не образуется, кроме того, до сих пор неизвестны ферменты, которые могли бы с ней взаимодействовать.
Вопросы для проверки усвоения материала
1 Какие молекулы являются индукторами РНК-интерференции?
2 Что такое «генная цензура»?
3 Какие молекулы относятся к классу малых РНК?
4 Как работает siRNA в клетках растений и животных?
5 Какова роль ферментов argonaute и DICER в РНК-интерференции?
6 Почему в РНК-интерференции участвуют именно двухцпочечные РНК?
7 Что такое интерферон? Чем его работа отличается от действия siRNA?
8 Какова функциональная роль РНК-интерференции?
9 Как используется явления РНК-интерференции в функциональной геномике?
10 Каковы перспективы применения малых РНК в экспериментальной генотерапии?
Дата добавления: 2021-05-28; просмотров: 689;











