Уравнение Ван-дер-Ваальса
(голландский физик, 1837 - 1923)
Ван-дер-Ваальс ввёл поправки в уравнение состояния идеального газа, учитывающие силы взаимодействия между молекулами и их собственный объём. Из уравнения Клапейрона – Менделеева для 1 моля 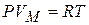 следует, что при
следует, что при 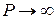
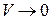 . Учтём в уравнении ограниченную сжимаемость газа. Заменим
. Учтём в уравнении ограниченную сжимаемость газа. Заменим 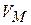 на
на 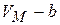 , где b – некоторая константа, учитывающая размеры молекул. Теперь при
, где b – некоторая константа, учитывающая размеры молекул. Теперь при 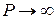
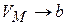 , т.е. смысл поправки b – это объём, к которому стремится моль газа при наиболее «плотной упаковке» молекул, а уравнение состояния с этой поправкой
, т.е. смысл поправки b – это объём, к которому стремится моль газа при наиболее «плотной упаковке» молекул, а уравнение состояния с этой поправкой 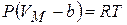 .
.
Учтём взаимодействие молекул. Сила взаимодействия между двумя элементарными объёмами пропорциональна плотности молекул, заключённых в одном и другом объёмах 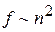 . Плотность – величина, обратная объёму, занимаемому молекулами.
. Плотность – величина, обратная объёму, занимаемому молекулами. 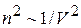 . Отсюда поправка на взаимодействие молекул
. Отсюда поправка на взаимодействие молекул 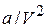 , где a – некоторая константа, характеризующая силы молекулярного притяжения. В результате уравнение состояния одного моля реального газа приняло вид:
, где a – некоторая константа, характеризующая силы молекулярного притяжения. В результате уравнение состояния одного моля реального газа приняло вид:
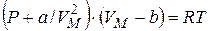
|
Это и есть уравнение Ван-дер-Ваальса. Здесь a и b – постоянные Ван-дер-Ваальса, для разных газов они имеют свои значения.
Заметим, что поправка 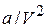 имеет размерность давления, и её часто называют внутренним давлением. На стенку сосуда такой газ оказывает давление Р, однако, если бы силы притяжения между молекулами мгновенно исчезли, то давление на стенку стало бы
имеет размерность давления, и её часто называют внутренним давлением. На стенку сосуда такой газ оказывает давление Р, однако, если бы силы притяжения между молекулами мгновенно исчезли, то давление на стенку стало бы 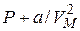 , т.е. при переходе от идеального газа к реальному давление на стенку уменьшается – из-за сил притяжения между молекулами. Поправка b связана с собственным объёмом молекул и её размерность
, т.е. при переходе от идеального газа к реальному давление на стенку уменьшается – из-за сил притяжения между молекулами. Поправка b связана с собственным объёмом молекул и её размерность 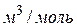 .
.
Дата добавления: 2016-12-27; просмотров: 2114;











