Изотермы реального газа
Для исследования поведения реального газа рассмотрим изотермы Ван-дер-Ваальса – кривые зависимости 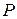 от
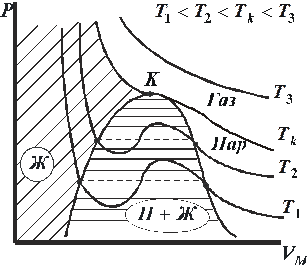
от 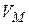 при заданных температурах Т, определяемые уравнением Ван-дер-Ваальса для 1 моля газа (рис. 9.2). Эти кривые рассматриваются для четырёх различных температур. При высоких температурах
при заданных температурах Т, определяемые уравнением Ван-дер-Ваальса для 1 моля газа (рис. 9.2). Эти кривые рассматриваются для четырёх различных температур. При высоких температурах 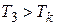 изотерма реального газа отличается от изотермы идеального газа только некоторым искажением её формы, оставаясь монотонно спадающей кривой. При некоторой температуре
изотерма реального газа отличается от изотермы идеального газа только некоторым искажением её формы, оставаясь монотонно спадающей кривой. При некоторой температуре 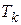 на изотерме имеется точка перегиба К. Эта изотерма называется критической, соответствующая ей температура
на изотерме имеется точка перегиба К. Эта изотерма называется критической, соответствующая ей температура 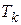 – критической температурой, а точка К – критической точкой. Состояние с критическими параметрами
– критической температурой, а точка К – критической точкой. Состояние с критическими параметрами 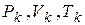 называется критическим состоянием.
называется критическим состоянием.
|
| Рис. 9.2 |
При температурах 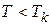 изотермы имеют волнообразный участок. У реальных изотерм такого завитка нет, вместо него у них имеется прямолинейный горизонтальный участок (на рис. 9.2 обозначены пунктиром). Если через крайние точки горизонтальных участков семейства изотерм провести линию, то получится колоколообразная кривая, ограничивающая область двухфазных состояний вещества. Эта кривая и критическая изотерма делят диаграмму P, V под изотермой на три области: под колоколообразной кривой располагается область двухфазных состояний (жидкость и насыщенный пар Ж+П), слева от неё находится область жидкого состояния (Ж), а справа – область пара (П). Пар отличается от остальных газообразных состояний тем, что при изотермическом сжатии претерпевает процесс сжижения. Газ же при температуре выше критической не может быть превращён в жидкость ни при каком давлении.
изотермы имеют волнообразный участок. У реальных изотерм такого завитка нет, вместо него у них имеется прямолинейный горизонтальный участок (на рис. 9.2 обозначены пунктиром). Если через крайние точки горизонтальных участков семейства изотерм провести линию, то получится колоколообразная кривая, ограничивающая область двухфазных состояний вещества. Эта кривая и критическая изотерма делят диаграмму P, V под изотермой на три области: под колоколообразной кривой располагается область двухфазных состояний (жидкость и насыщенный пар Ж+П), слева от неё находится область жидкого состояния (Ж), а справа – область пара (П). Пар отличается от остальных газообразных состояний тем, что при изотермическом сжатии претерпевает процесс сжижения. Газ же при температуре выше критической не может быть превращён в жидкость ни при каком давлении.
2. Метастабильные состояния (греч. meta – после, за, в данном случае за стабильным состоянием, неустойчивые состояния).
Рассмотрим часть изотермы 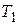 рис. 9.3. Состояния на участке 2-3 не реализуются, т.к. на нём
рис. 9.3. Состояния на участке 2-3 не реализуются, т.к. на нём 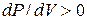 , т.е. увеличение объёма газа сопровождалось бы не уменьшением, а ростом давления – совершенно противоестественное свойство. На участках 1-2 и 3-4
, т.е. увеличение объёма газа сопровождалось бы не уменьшением, а ростом давления – совершенно противоестественное свойство. На участках 1-2 и 3-4 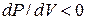 , это нормально, но оказывается, что эти состояния не вполне устойчивы. Достаточно в состоянии А попадание в пар пылинки, чтобы вещество распалось на две фазы и перешло в состояние В. (Напомним, что фазой называется однородная, одинаковая по свойствам часть системы. Например, в закрытом сосуде вода и смесь воздуха и паров воды. Пар, находящийся вравновесии со своей жидкостью называетсянасыщенным.
, это нормально, но оказывается, что эти состояния не вполне устойчивы. Достаточно в состоянии А попадание в пар пылинки, чтобы вещество распалось на две фазы и перешло в состояние В. (Напомним, что фазой называется однородная, одинаковая по свойствам часть системы. Например, в закрытом сосуде вода и смесь воздуха и паров воды. Пар, находящийся вравновесии со своей жидкостью называетсянасыщенным.
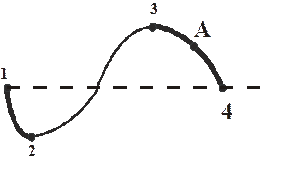
| Давление, при котором наблюдается равновесие, называется давлением насыщенного пара 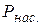 ). Состояния, подобные состоянию А (неустойчивые) называются метастабильными. Состояние 1-2, где давление меньше ). Состояния, подобные состоянию А (неустойчивые) называются метастабильными. Состояние 1-2, где давление меньше 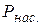 при данной температуре называется перегретой жидкостью, а 3-4 при данной температуре называется перегретой жидкостью, а 3-4
|
| Рис. 9.3 |
( 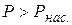 ) – пересыщенным паром. Рассмотрим состояние пересыщенного пара. Для образования капелек жидкости необходимо сближение молекул на расстояние порядка расстоянию между молекулами в жидкости. Для этого необходимо наличие центров конденсации (пылинки, заряженные частицы, капельки жидкости). В камере Вильсона (английский учёный, лауреат Нобелевской премии 1927г.) воздух, насыщенный парами воды резко расширяется и, соответственно, охлаждается. Пары оказываются в состоянии перенасыщения. Если заряженная частица попадёт в камеру, то пар конденсируется на ней в мелкие капельки, образуя видимый след («трек») при её движении.
) – пересыщенным паром. Рассмотрим состояние пересыщенного пара. Для образования капелек жидкости необходимо сближение молекул на расстояние порядка расстоянию между молекулами в жидкости. Для этого необходимо наличие центров конденсации (пылинки, заряженные частицы, капельки жидкости). В камере Вильсона (английский учёный, лауреат Нобелевской премии 1927г.) воздух, насыщенный парами воды резко расширяется и, соответственно, охлаждается. Пары оказываются в состоянии перенасыщения. Если заряженная частица попадёт в камеру, то пар конденсируется на ней в мелкие капельки, образуя видимый след («трек») при её движении.
Рассмотрим перегретую жидкость. Если жидкость тщательно очистить от твёрдых включений, то путём нагревания или понижения давления до 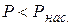 её можно перевести в состояние перегрева. Прохождение заряженной частицы приводит к образованию вдоль следа частицы зародышевых центров кипения. Пузырьки фотографируют.
её можно перевести в состояние перегрева. Прохождение заряженной частицы приводит к образованию вдоль следа частицы зародышевых центров кипения. Пузырьки фотографируют.
Критическое состояние
Рассмотрим подробнее состояние в т. К (рис. 9.2.). В этой точке различие в плотностях жидкости и насыщенного пара полностью исчезает. Одновременно исчезает всякое различие между жидкостью и паром. Границы раздела между жидкостью и паром также нет. Первая и вторая производные давления по объёму равны нулю.
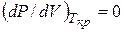 ;
; 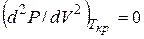 .
.
3. Внутренняя энергия реального газа. Кроме кинетической энергии включает потенциальную энергию взаимодействия молекул газа. Работа, совершаемая при расширении газа против сил взаимного притяжения молекул друг к другу, равна приращению энергии взаимодействия 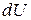 . Ван-дер-Ваальса поправка к давлению
. Ван-дер-Ваальса поправка к давлению 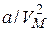 . Тогда работа
. Тогда работа 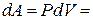
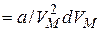 , отсюда потенциальная энергия
, отсюда потенциальная энергия
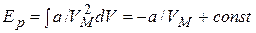
При 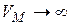 реальный газ стремится к идеальному и тогда
реальный газ стремится к идеальному и тогда 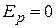 :
:
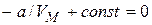
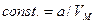 .
.
Ранее для кинетической энергии хаотического теплового движения молекул было получено: 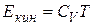 .
.
Внутренняя энергия реального газа, учитывающая и кинетическую и потенциальную энергии:
 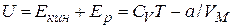
|
То есть внутренняя энергия моля Ван-дер-Ваальского газа есть функция состояния газа.
4. Эффект Джоуля-Томсона
Эффект Джоуля – Томсона заключается в изменении температуры газа в результате адиабатического дросселирования – медленного протекания газа под действием постоянного перепада давления через дроссельное препятствие (например, пористую перегородку Др - дроссель на рис. 9.4). Термин «адиабатическое» означает без теплообмена с окружающей средой. Адиабатичность может быть осуществлена, например, с помощью теплоизолирующей оболочки вокруг канала. При
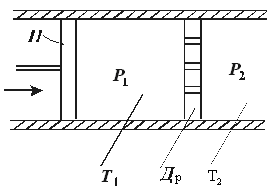
| перемещении поршня (П) образуется постоянный перепад давлений 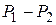 ( ( 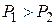 ). Различают а) положительный эффект для Т, когда температура реального газа понижается ). Различают а) положительный эффект для Т, когда температура реального газа понижается 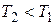 и б) отрицательный эффект, когда и б) отрицательный эффект, когда 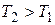 (для идеального газа T=const). Практический интерес представляет положительный эффект. Положительный эффект наблюдается в области давлений, где преобладают силыпритяжения (для идеального газа T=const). Практический интерес представляет положительный эффект. Положительный эффект наблюдается в области давлений, где преобладают силыпритяжения
|
| Рис. 9.4 |
между молекулами. При расширении молекулы газа совершают работу против сил притяжения и температура уменьшается. При этом кинетическая энергия теплового движения газа расходуется на работу против сил молекулярного притяжения.
Изменение температуры может быть значительным. Например, воздух, расширяясь при комнатной температуре от давления 200 атм до давления 1 атм охлаждается примерно на 40 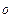 .
.
Процесс используется в технике для сжижения газов. На эффекте Джоуля – Томсона основана работа так называемой машины Линде.
Сжижение газов и получение низких температур
Газ может быть превращён в жидкое состояние, если его температура ниже критической и ниже температуры кипения при данном давлении.
Машина Линде (немецкий учёный) (Рис. 9.5)
Атмосферный воздух сжимается компрессором (К) до давления 220 атм. Сжатый воздух проходит по трубопроводу и охлаждается проточной водой до 10 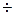 15
15  . Далее воздух поступает во внутренний канал
. Далее воздух поступает во внутренний канал
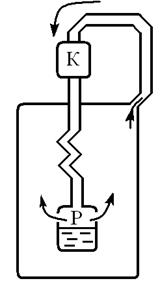
| змеевика откуда в резервуар (Р), где давление 20 атм. При этом воздух охлаждается на 50  .(Расширение происходит в области положительного эффекта Джоуля – Томсона). Охлаждённый воздух по наружному каналу змеевика отводится к компрессору, охлаждая следующие порции воздуха, идущие по внутреннему каналу и т.д. При температуре 180 .(Расширение происходит в области положительного эффекта Джоуля – Томсона). Охлаждённый воздух по наружному каналу змеевика отводится к компрессору, охлаждая следующие порции воздуха, идущие по внутреннему каналу и т.д. При температуре 180  и давлением 20 атм. начинается конденсация воздуха. Жидкий воздух стекает в резервуар. и давлением 20 атм. начинается конденсация воздуха. Жидкий воздух стекает в резервуар.
| |
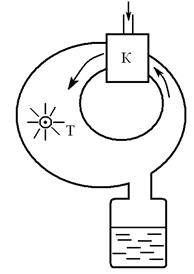
| Турбодетандер Капицы (русский учёный, лауреат Нобелевской премии, 1894 – 1984). Газ, сжатый компрессором (К) до давления 6-7 атм, поступает в турбину (Т), расширяется до давления 1,3 атм., совершает работу, охлаждается, далее охлаждает газ, поступающий в компрессор, циркулирует и т.д., и, наконец, конденсируется. Таким методом можно получить жидкие азот, кислород, водород, гелий. (Отметим, что температура кипения жидкого кислорода 90К, азота 78К, водорода 20К, гелия 4,2К). Применяются жидкие газы в металлургии, медицине, авиации. | ||
| Рис. 9.5 | ||
| ||
| Рис. 9.6 |
Дата добавления: 2016-12-27; просмотров: 8615;











