ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА УГЛЕВОДОРОДНЫХ ГАЗОВ
Нефтяной газ при нормальных условиях содержит неполярные углеводороды - смесь углеводородовв от С1 до С4: метан, этан, пропан, изо-бутан и н-бутан. С точки зрения физики к ним можно применять законы для идеальных систем. С точки зрения математики – это аддитивная система. Следовательно, для оценки свойств нефтяного газа (при нормальных или стандартых условиях) применимы аддитивные методы расчётов физико-химических и технологических параметров (Псмеси):
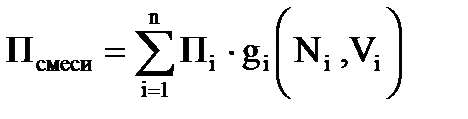 , (2.3)
, (2.3)
где gi – весовая доля;
Ni – мольная доля;
Vi – объёмная доля;
Пi – параметр i-го углеводорода или неуглеводородного компонента.
Например, плотностьсмеси газов рассчитывается следующим образом:
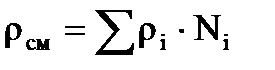 . (2.4)
. (2.4)
Плотность газа можно расчитать через отношение молекулярной массы газа (Mi) к мольному объему (Vм). Например, для нормальных условиях (н.у.):
rг = Mi / 22,414. (2.5)
Нефтяной газ представлен в виде смеси углеводородов, поэтому для оценки его физико-химических свойств по формуле (2.3) необходимо знать, как выражается состав смеси.
Массовая доля (gi) – отношение массы i-го компонента (mi), содержащегося в системе к общей массе системы:
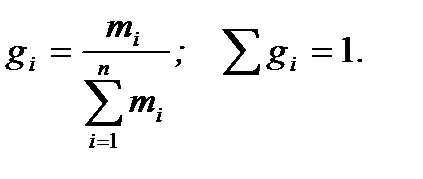 (2.6)
(2.6)
Молярная (мольная) доля (Ni) – отношение числа молей i-го компонента (тш) к общему числу молей в системе:
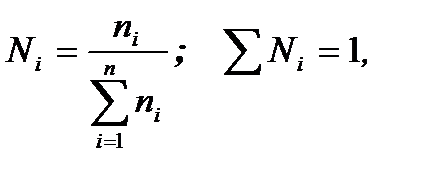
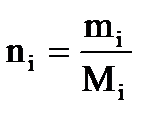 , (2.7)
, (2.7)
где mi – масса i-го компонента;
Мi – молекулярный вес i-го компонента.
Из соотношений (2.6 – 2.7) легко найти выражения для пересчетов массового и мольного составов:
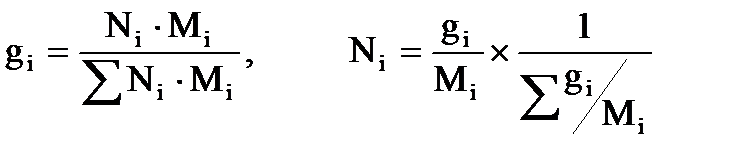 (2.8)
(2.8)
Объёмная доля – это доля (Vi), которую занимает компонент в объёме системы и с учетом выражений (2.5 – 2.8) можно найти взаимосвязь ее с массовым и мольным составами:
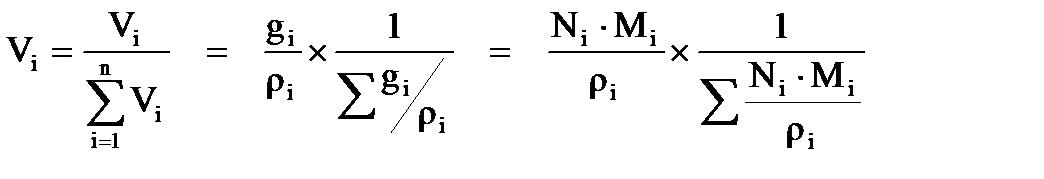 (2.9)
(2.9)
Для идеального газа соблюдается соотношение: объемная доля компонента (Vi ) равна мольной доли компонента (Ni), Vi = Ni , как следствие закона Авогадро. Для идеальной системы, как нефтяной газ, состав его можно рачитать на основе любых данных: масс компонентов, объемов, плотностей, парциальных давлений и др., см. раздел "Практикум для самостоятельной работы".
Молекулярная масса смеси рассчитывается по принципу аддитивности для смесей, состав которых выражен в мольных или объемных долях (2.10, левое выражение). Для смесей, состав которых выражен в ммассовых процентах по формуле 2.10, правое выражение:
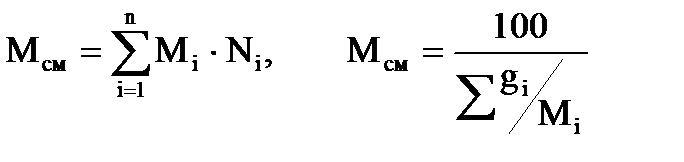 (2.10)
(2.10)
Относительная плотность газа расчитывается по отношению к плотности воздуха:
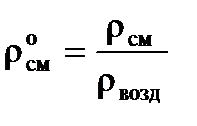 . (2.11)
. (2.11)
Для нормальных условий (н.у.) ρвозд » 1,293; для стандартных условий (с.у.) ρвозд » 1,205.
Если плотность газа (ρо) задана при атмосферном давлении = 0,1013 МПа, то пересчёт её на другое давление (Р) при той же температуре для идеального газа производится по формуле:
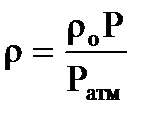 . (2.12)
. (2.12)
Смеси идеальных газов характеризуются аддитивностью парциальных давлений и парциальных объёмов.
Для идеальных газов давление смеси равно сумме парциальных давлений компонентов (закон Дальтона):
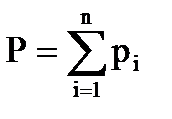 , (2.13)
, (2.13)
где Р – давление смеси газов;
рi – парциальное давление i-го компонента в смеси,
или
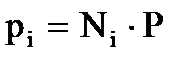 . (2.14)
. (2.14)
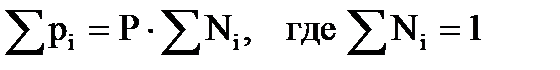 . (2.15)
. (2.15)
Т. е. парциальное давление газа в смеси равно произведению его молярной доли в смеси на общее давление смеси газов (2.14).
Аддитивность парциальных объёмов компонентов газовой смеси выражается законом Амага:
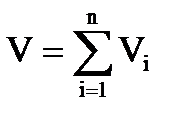 , (2.16)
, (2.16)
где V – объём смеси газов;
Vi – объём i-го компонента в смеси.
или анологично уравнениям (2.14 – 2.15) выражением 2.17:
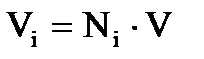 . (2.17)
. (2.17)
Для определения многих физических свойств природных газов используется уравнение состояния.
Уравнением состояния называется аналитическая зависимость между параметрами, описывающими изменение состояние вещества. В качестве таких параметров используется давление, температура, объём.
Состояние газа при нормальных и стандартных условиях характеризуется уравнением состояния Менделеева-Клайперона:
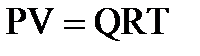 , (2.18)
, (2.18)
где Р – абсолютное давление, Па;
V – объём, м3;
Q – количество вещества, кмоль;
Т – абсолютная температура, К;
R – универсальная газовая постоянная, Па×м3/(кмоль×град).
На основе уравнения состояния газа можно рассчитать много параметров для системы нефтяного газа: плотность, мольный объем, количество молекул, число молекул, парциальные давления и др., если рассматривать уравнение состояния газа для 1 моля, т.е., Q = ∑Ni и PV = ∑NiRT, см. раздел "Практикум для самостоятельной работы".
У этого уравнения есть свои граничные условия. Оно справедливо для идеальных газов при нормальном, атмосферном давлении (1 атм) и близких к нормальному давлениях (10-12 атм).
При повышенном давлении газ сжимается. За счёт направленности связи С-Н происходит перераспределение электронной плотности, и молекулы газов начинают притягиваться друг к другу (физическое взаимодействие).
Для учёта этого взаимодействия в уравнение (2.18) вводится коэффициент сверхсжимаемости z, предложенный голландским физиком Ван-дер-Ваальсом, учитывающий отклонения поведения реального газа от идеального состояния:
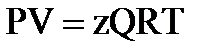 , (2.19)
, (2.19)
где Q – количество вещества, моль;
z – коэффициент сверхсжимаемости.
Физический смысл коэффициента сверхсжимаемости заключается в расширении граничных условий уравнения Менделеева - Клайперона для высоких давлений.
Коэффициент z зависит от давления и температуры (приведенных, критических давлений и температуры), природы газа.
Критическое давление – давление, при котором газообразный углеводород переходит в жидкое состояние.
Дата добавления: 2016-12-27; просмотров: 3168;











