Поверхностная активность веществ.
Вещества, понижающие поверхностное натяжение воды, называют поверхностно-активными веществами (ПАВ). Как правило, молекулы ПАВ имеют асимметричное и дифильное строение, т.е. содержат гидрофильную полярную группу и гидрофобный неполярный радикал. К ПАВ относятся, в частности, растворимые в воде органические кислоты и их соли, спирты, сложные эфиры, амины, белки, фосфолипиды и др. В частности, содержащиеся в желчи соли желчных кислот (холевой, гликохолевой и таурохолевой) представляют собой поверхностно-активные вещества, которые способны снижать поверхностное натяжение на границе вода – воздух или на границе вода – масло. В случае эмульсии масла в воде введение желчных кислот приводит к тому, что крупные капли, вследствие снижения поверхностного натяжения на границе двух фаз, распадаются на ряд мелких. Кроме того, пленка желчных кислот, образующаяся на поверхности капелек эмульсии, препятствует их слиянию (структурно – механический фактор стабилизации). Эмульгирование жиров при помощи желчных кислот имеет большое значение для переваривания пищи в кишечнике.
ПАВ делятся на анионоактивные, катионоактивные, неионогенные и амфотерные.
К анионоактивным ПАВ относятся:
а) соли высших карбоновых кислот RCOONa (С11 < R < C18, например, пальмитат натрия С15Н31СОО-Na+);
б) соли сульфокислот R-C6H4-SО3-Na+ (R > С12, например, додецилбензолсульфонат натрия C12H25-C6H4-SO3-Na+);
в) соли алкилсерных кислот ROSО3-Na+ (R > С12, например, додецилсульфат натрия С12Н25-О-SОз- Na+).
К катионоактивным ПАВ относятся:
а) соли и основания тетраалкиламмония [RR1R2R3N+]X- (C8 < R < C16), например, триметилцетиламмоний хлорид [C16H33-N(CH3)3]+Cl-;
б) соли алкилпиридиния (например, цетилпиридиний иодид). Неионогенные ПАВ представлены соединениями следующей общей формулы: R-X(CH2CH2О)nH [R = Alk, X = О, N, S или –COO-, -CONH-, -С6Н4О-, n = 8-12; например, препарат ОП-10 – C8H17-C6H4-0-(CH2CH2O)10H].
Неионогенными ПАВ являются также высшие предельные спирты, например, цетиловый спирт C16Н33ОН, длинноцепочечные амины и др.
Амфотерные ПАВ имеют общую формулу: O+-R-K- (C9 < R < С19,O + - основная группа, К- - кислотная группа, например, N-додецил-β-аланин C12H25-NH2+-CH2-CH2-COO-).
Существует правило Дюкло-Траубе:для низших членов гомологического ряда жирных кислот, спиртов и аминов с увеличением углеводородной цепи на группу -СН2- поверхностная активность веществ возрастает в 3-3,5 раза при одинаковой молярной концентрации. Это правило иллюстрируется на рисунке, где представлена зависимость поверхностного натяжения от концентрации для гомологов карбоновых кислот.
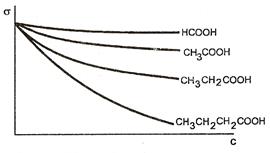
Рис. 23. Семейство изотерм поверхностного натяжения для гомологического
ряда карбоновых кислот.
Моющее действие ПАВ заключается в следующем. По преимуществу частицы загрязняющих веществ (например, жира) гидрофобны, а, следовательно, не смачиваются водой. Поэтому чистая вода обладает слабым моющим действием. Если применить ПАВ, его молекулы адсорбируются на частицах загрязнителя, ориентируясь гидрофобными участками к его молекулам, а гидрофильными - к молекулам воды.
Моющее действие ПАВ
Поскольку вода будет находиться в контакте только с полярными группами, которые легко ассоциируются с ней, частицы загрязняющих веществ окажутся растворенными в воде и будут легко смываться ею. В результате молекулы ПАВ постепенно проникают между очищаемой поверхностью и частицами загрязнителя. Это явление называют расклинивающим эффектом. В итоге частицы грязи отделяются от загрязненной поверхности.
В живых системах ПАВ играют совершенно исключительную роль, совмещая в своей структуре две системы - гидрофильную и гидрофобную. Именно такие вещества формируют основу тех клеточных мембран, которые обладают и гидрофильными, и гидрофобными свойствами одновременно. Вещества этих клеточных мембран могут в сильной мере отличаться химическим строением, однако их общая особенность - наличие двух частей с принципиально различающимися физико-химическими свойствами.
Несмотря на структурные различия, множество молекул природных ПАВ, например, содержащие остаток фосфорной кислоты фосфолипиды и сфиголипиды, имеют весьма сходные размеры -длину около 30 Å и диаметр около 5 Å.
Липофильная часть природных ПАВ состоит из углеводородного радикала с достаточной для проявления липофильности величиной. Этот радикал может быть линейного строения, и тогда его величина должна превышать 12 углеродных атомов. Набор таких радикалов, реализующихся в биоструктурах, превышает сотню разновидностей. Другой тип радикалов - полициклические радикалы стероидного ряда, как это, к примеру, имеет место в молекулах желчных кислот, высокая поверхностная активность которых способствует диспергированию пищи в мельчайшие частицы, необходимые для их последующего усвоения.
Гидрофильная часть природных ПАВ имеет в своем составе полярный остаток фосфорной, серной или карбоновой кислоты. Это может быть также аммонийный ион (в белковых ПАВ) или сахаридный остаток, например, в молекулах некоторых сфинголипидов.
Для однородной гладкой поверхности, каковыми являются границы раздела газ - жидкость и жидкость - жидкость, широко распространена теория мономолекулярной адсорбции Ленгмюра. Согласно ей, адсорбция является равновесным процессом.
Вещества, незначительно повышающие поверхностное натяжение, называют поверхностно-инактивными; например: неорганические кислоты, основания, соли, глицерин, α-аминокислоты. Вещества, не изменяющие поверхностное натяжение, называют поверхностно-неактивными; к ним относятся сахароза, глюкоза и ряд других веществ.
Адсорбция.
Самопроизвольное снижение свободной поверхностной энергии GЅ в однокомпонентных системах возможно только за счет уменьшения площади поверхности раздела фаз. В многокомпонентных системах снижение GSвозможно также за счет уменьшения поверхностного натяжения за счет самопроизвольного перераспределения молекул компонента между объемом фазы и поверхностным слоем.
Самопроизвольное изменение концентрации растворенного вещества на границе раздела фаз называют адсорбцией. Если происходит концентрирование вещества (адсорбата) в поверхностном слое, то адсорбцию называют положительной. Положительно адсорбируются поверхностно-активные вещества. В случае, когда концентрация вещества в объеме фазы больше, чем в поверхностном слое, говорят об отрицательнойадсорбции.
Количественной мерой адсорбции на подвижной границе раздела фаз служит величина адсорбции Г (гамма); единица измерения — моль/м2.
Связь между величиной адсорбции и коэффициентом поверхностного натяжения устанавливает уравнение Гиббса:
Г = – 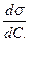 .
. 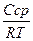 ;
;
где Сср — средняя концентрация раствора ПАВ, моль/л;
R — универсальная газовая постоянная, равная 8,31 Н · м/(моль · К);
Т — температура, К;
- dσ/dC =g — поверхностная активность.
|
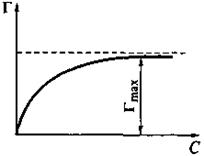
Уравнение Гиббса позволяет рассчитать величину адсорбции Г (если известно поверхностное натяжение σ) и построить изотерму адсорбции (зависимость величины адсорбции от равновесной концентрации вещества при постоянной температуре; вид изотермы представлен рис. 24).
Рис. 24. Изотерма адсорбции ПАВ на границе раздела раствор —газ
С увеличением концентрации ПАВ величина адсорбции возрастает сначала резко, а затем дальнейшее увеличение концентрации ПАВ вызывает незначительное увеличение адсорбции Г и, в конце концов, величина адсорбции перестает зависеть от концентрации ПАВ.
Величина Гmах (другое обозначение Г∞) называется предельной адсорбцией; она отвечает образованию на поверхности насыщенного мономолекулярного адсорбционного слоя.
При малых концентрациях ПАВ углеводородные радикалы "лежат" на поверхности полярной жидкости, а полярные группировки погружены в нее (рис. 25, а). При достижении предельной величины адсорбции Г∞ молекулы ПАВ образуют на поверхности мономолекулярный слой, в котором неполярные углеводородные радикалы располагаются перпендикулярно к поверхности ("частокол Ленгмюра", рис. 25, б).
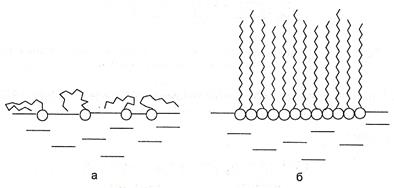
Рис. 25. Молекулы ПАВ на поверхности воды:
а - при малых концентрациях, б - в мономолекулярном слое.
По значению Гmах можно найти площадь поперечного сечения молекул Ѕ и ее осевую длину L, равную толщине насыщенного адсорбционного слоя: 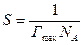 ;
; 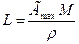 ;
;
где NA — постоянная Авогадро, моль-1; М — молярная масса ПАВ, кг/моль; р — плотность ПАВ, кг/м3. Следовательно, зная константу Г∞ из уравнения Ленгмюра, можно определять размеры молекул.
Величина адсорбции уменьшается при увеличении температуры; это обусловлено увеличением интенсивности теплового движения молекул и разупорядочиванием мономолекулярного слоя.
Для описания изотерм адсорбции наиболее часто в медико-биологических исследованиях используют изотермы Фрейндлиха и Ленгмюра (рис. 26)
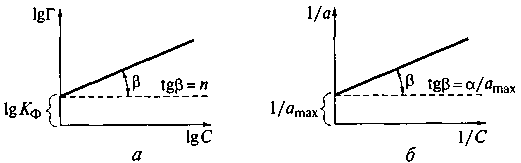
|
Рис. 26. Изотерма адсорбции Фрейндлиха (а)и Ленгмюра (б)
(1/amax = 1/Г max, a/ amax =Г/Г max , 1/a =1/Г)
1. Изотерма Фрейндлиха:
Г = КФ Сп,
где Кф — константа, численно равная адсорбции при равновесной концентрации, равной единице; п = 0,1 — 0,6 — константа, определяющая кривизну изотермы адсорбции.
Изотерма Фрейндлиха представляет собой уравнение параболической кривой. Для нахождения постоянных Кф, п в уравнении Фрейндлиха проводят его логарифмирование и приводят к уравнению прямой:
lgГ = lgКф + n lgC
Отрезок ординаты от начала оси до ее пересечения с прямой равен lgКф, а тангенс угла наклона прямой равен п (см. рис. 26, а).
2. Изотерма Ленгмюра: 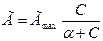
где Г — величина адсорбции; Гmах — константа, равная предельной адсорбции, наблюдаемой при относительно больших равновесных концентрациях, моль/м2; α — константа, равная отношению константы скорости десорбции к константе скорости адсорбции; она численно совпадает с равновесной концентрацией, при которой Г = 0,5 Гmах.
В отличие от уравнения Фрейндлиха уравнение Ленгмюра описывает ход экспериментальной изотермы при всех возможных значениях равновесных концентраций; когда С «α , уравнение приобретает вид:
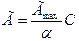
Такая зависимость является уравнением прямой, проходящей через начало осей координат. При больших концентрациях, когда С<< а, уравнение Ленгмюра принимает вид: а = а mах. Такая зависимость является уравнением прямой, проходящей параллельно оси абсцисс и отсекающей на оси ординат отрезок, численно равный Г mах.
Для нахождения констант в уравнении Ленгмюра его приводят к уравнению
прямой:
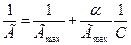
Данное уравнение является уравнением прямой, не проходящей через начало осей координат. Отрезок ординаты от начала оси до ее пересечения с прямой равен 1/Г maх, а тангенс угла наклона прямой равен Г/Гmах (см. рис. 26, б)
Дата добавления: 2019-09-30; просмотров: 1207;











