Пространствеая структура биоорганических молекул. Виды изомерии
(Материал для самоподготовки)
Многообразие органических соединений обусловлено в значительной мере явлением изомерии.
Изомерами называются соединения с одинаковым качественными количественным составом, но отличающиеся последовательностью связывания атомов или расположением их в пространстве.
Даже минимальные структурные различия между изомерами биомолекул приводят к заметным различиям в их физических и химических свойствах и очень сильно влияют на их биологическую активность. Возможны следующие типы изомерии: структурнаяи пространственная (стереоизомерия).
Структурная изомерия. Этот тип изомерии обусловлен различным взаимным расположением атомов в молекулах.
При этом различают изомерию углеродного скелета и изомерию положения.
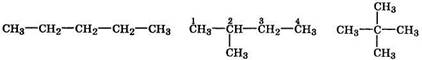
Изомерия углеродного скелета обусловлена способностью атомов углерода образовывать как прямые (нормальные)углеродные цепи, так и разветвленныецепи с различной степенью разветвления. Например, у пентана имеются три изомера:
|
н-пентан 2-метилбутан 2,2-диметилпропан
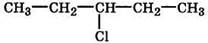
Изомерия положения обусловлена различным положением заместителей, функциональных групп или кратных связей в молекулах органических соединений одинакового состава. Например:

|
— перемещение заместителя по цепи:
|
1-хлорпентан 2-хлорпентан
8-хлорпентан

|
— перемещение кратной связи по цепи:
пентен-1 пентен-2
— взаимное расположение заместителей в соединениях ароматического ряда:

|
1,2-диметилбензол 1,8-диметилбензол 1,4-диметилбензол
(opтo-ксилол) (мета-ксилол) (пара-ксилол)
Для рассмотренных видов структурной изомерии взаимное превращение изомеров друг в друга при обычных условиях отсутствует.
Классовая изомерия также является примером структурной изомерии и определяется различной очередностью расположения атомов в молекулах веществ, относящихся к различным классам. Примером изомерии данного вида могут молекулы этилового спирта и диметилового эфира: молекулярная формула которых – C2H6O, а структурные формулы веществ соответственно можно представить следующим образом: CH3-CH2-OH и CH3-O-CH3
Особым случаем структурной изомерии является таутомерия.
Таутомерия — явление равновесной динамической изомерии, при которой происходит быстрое обратимое самопроизвольное превращение структурных изомеров, сопровождаемое миграцией подвижной группы между двумя или несколькими центрами в молекуле.
Таутомерия свойственна соединениям, в молекулах которых имеются разные реакционноспособные группировки. Например, в молекулах природных аминокислот имеются две группы с противоположными свойствами: аминогруппа - основные свойства - и карбоксильная группа — кислотные свойства. Между этими группами осуществляется перенос протона, и поэтому такой вид изомерии называется прототропной таутомерией. Для обозначения таутомерного равновесия в учебнике использованы пунктирные стрелки.
H2N—CHR—СООН <=> H3 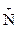 —CHR—СОО-
—CHR—СОО-
Для всех природных аминокислот в кристаллическом состоянии и в водных растворах наиболее устойчив таутомер, имеющий структуру биполярного иона. Его содержание превышает 99,9%. Поэтому во многих учебных пособиях все природные α-аминокислоты всегда изображены в виде таутомера с биполярно-ионной структурой.
Прототропная таутомерия бывает разных видов: кето-енольная, лактим-лактамная и др. Кроме прототропной таутомерии в природных соединениях наблюдается кольчато-цепная таутомерия, которая особенно характерна для углеводов. Данные виды изомерии будут более подробно рассмотрены в соответствующих главах.
ГЛАВА 2. ЭЛЕКТРОННОЕ СТРОЕНИЕ ОРГАНИЧЕСКИХ МОЛЕКУЛ. КИСЛОТНОСТЬ И ОСНОВНОСТЬ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ.
Вопросы к занятию.
1. Понятие об оптической изомерии органических соединений.
2. Асимметрические атомы углерода. Хиральные молекулы.
3. Относительная и абсолютная конфигурация молекул. Проекции Фишера.
4. Индуктивный электронный эффект.
5. Мезомерный электронный эффект. Сопряженные системы.
6. Понятие об ароматичности (бензол и небензоидные системы).
7. Электронно-донорные и электронно-акцепторные заместители в ароматическом кольце.
8. Кислотность и основность органических молекул.
9. Понятие о С-Н, О-Н, S-H, N-H кислотах.
10. Влияние электронных эффектов на кислотность и основность.
Дата добавления: 2019-09-30; просмотров: 595;











