Сущность явления электролитической диссоциации
Шведский ученый Свант Аррениус (1839-1927), занимаясь изучением
электропроводности растворов, обратил внимание на то, что все растворы со-
лей, кислот, оснований, которые не подчиняются законам Вант-Гоффа и Рауля,
обладают способностью проводить электрический ток. Он провел исследования
электропроводности растворов в зависимости от концентрации растворенных
веществ и обнаружил, что с увеличением концентрации растворенных веществ
увеличивается и электропроводность растворов. На основании результатов сво-
их опытов С. Аррениус показал, что, измеряя электропроводность растворов,
можно рассчитать также и величину изотонического коэффициента, а соответ-
ственно, и осмотическое давление и температуры начала кипения и кристалли-
зации растворов.
Величины изотонического коэффициента, выведенные из изучения элек-
тропроводности растворов, оказались близки величинам изотонического коэф-
фициента, полученным Вант-Гоффом при изучении осмотического давления
тех же растворов. С. Аррениус высказал смелую гипотезу, что молекулы рас-
творенного вещества в растворе распадаются (под действием молекул раство-
рителя) на заряженные частицы (подвергаются электролитической диссоциации).
– ионы, которые и обуславливают перенос электрических зарядов, т.е. электропроводность растворов. При этом под действием электрического поля катионы (+) двигаются к катоду (-), а анионы (-) – к аноду (+).
Распад молекул на ионы ─ это увеличение концентрации частиц в рас-
творе и как следствие, увеличение того или иного свойства растворов (осмоти-
ческого давления, например), зависящего от концентрации частиц.
Если бы, например, хлорид натрия NaCl находился бы в воде в виде целых молекул, то коэффициент изотонический должен быть равен единице. Но так как в действительности коэффициент i значительно больше единицы, есте-
ственно принять, что хлорид натрия частично диссоциирован (распался) на ио-
ны. Поэтому в данном случае при разбавлении изотонический коэффициент стремится к целочисленному значению i = 2. А в случае, например, ВаСl2, молекула которого распадается на три частицы (ион Ва2+ и два иона Сl-), изотонический коэффициент должен быть при предельном разбавлении равен i = 3.
Приняв гипотезу С. Аррениуса, становится понятным и физический
смысл понятия изотонического коэффициента. Он показывает – во сколько раз
увеличилось количество частиц в растворе по сравнению с растворенным коли-
чеством:
фактическое количество частиц растворенного вещества в единице объема
i= ————————————————————————————————
число растворяемых частиц ( молекул) в единице объема
Взаимодействие между молекулами растворенного вещества и раствори-
теля при растворении настолько сильное, что молекулы растворенного вещест-
ва теряют свою индивидуальность, превращаются в ее фрагменты. Процесс
растворения, как таковой, сопровождается деструкцией первоначальных (ис-
ходных) частиц растворяемого вещества.
В дальнейшем С. Аррениус развил свою гипотезу в стройную теорию,
получившую название теории электролитической диссоциации.
Вещества, которые в расплавах и полярных растворителях распадаются на ионы и обладают ионной проводимостью называют электролитами.
Изучение растворов электролитов показало. что изотонический коэффи-
циент i только в небольших случаях приближается к целочисленным значениям
(1, 2, 3, 4 …) даже при бесконечно больших разбавлениях. В основном же он
имеет дробные значения (см. табл.2.1). Из чего можно заключить, что не все рас-
творенные молекулы диссоциируют на ионы. Измерения электропроводности
также показывают, что с разбавлением растворов электропроводность повыша-
ется, а с увеличением концентрации растворенного вещества после определен-
ного значения происходит ее понижение. Очевидно, это явление связано с не-
полной и обратимой диссоциацией молекул растворенного вещества, т.е. наря-
ду с процессом распада молекул происходит соединение распавшихся частиц с
образованием исходных молекул или ионных ассоциатов, которые образуют контактные ионные пары. Растворение веществ немолекулярного строения, имеющих ионную кристаллическую решетку в полярном растворителе протекает последовательным отрывом с поверхности твердого электролита катионов и анионов, например, того же хлорида натрия KCl:
KClраствор ↔ K+раствор + Cl-раствор .
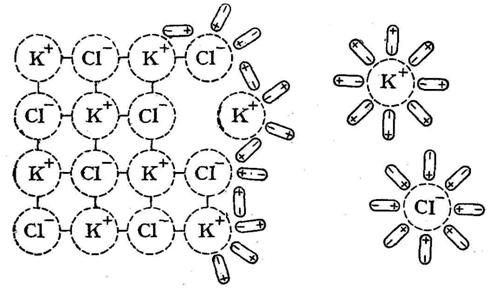
Рис. 2.1. Растворение кристаллов хлорида калия
BaCl2 ↔ Ва+2 + 2Cl-
В растворе молекулы попадают под влияние электрического
поля соседних молекул растворителя и в них могут произойти существенные
изменения, связанные со структурой молекул. В частности, молекулы которые
неполярные сами по себе, становятся полярными, связи между частицами в
молекулах растворенного вещества деформируются, ослабляются и возможен
их полный разрыв. В результате в растворе из молекулы растворенного вещест-
ва появляются ионы, окруженные полярными молекулами растворителя (гово-
рят: сольватированные ионы, в общем случае или гидратированные ионы, в
случае водного растворителя).
Полярность молекул растворителя оказывает большое влияние на про-
цесс и растворения и диссоциации молекул растворенного вещества. Чем выше
дипольный момент, тем выше их способность и растворять, и тем вероятнее процесс диссоциации растворенных молекул. Дипольный момент µ характеризует только отдельно взятые молекулы, а диэлектрическая проницаемость ─ их общее свойство как среды (растворителя, растворов) разных веществ и концентраций, и поэтому она
более удобна в практическом отношении.
Диэлектрическая проницаемость ε показывает, во сколько раз напряженность поля (Е среда) с данным веществом ниже, чем напряженность поля в вакууме (Е вакуум ): ε = Евакуум / Есреда .
Растворитель, характеризующийся большим значением диэлектрической по-
стоянной ε, ослабляет стремление ионов соединиться в молекулы в большей
степени. Электрическое поле создаваемое ионами растворенного электролита ослабляется полем создаваемым полярными молекулами растворителя.
Таким образом, чем больше диэлектрическая проницаемость среды, тем в
большей степени ионы изолированы друг от друга в растворе.
Эти рассуждения согласуются с эмпирическим правилом: степень диссо-
циации растворенного вещества при данных условиях пропорциональна ди-
электрической постоянной растворителя.
Значения диэлектрической проницаемости некоторых растворителей при
25 о С приведены в таблице 2.2.
Таблица 2.2. Диэлектрическая проницаемость некоторых растворителей
| Растворитель | вода Н2О | муравьиная кислота НСООН | Этиловый спирт С2Н5ОН | Ацетон С3Н6О | хлороформ CHCl3 | Бензол С6Н6 |
| Диэлектрическая проницаемость | 78,3 | 57,9 | 25,2 | 20,7 | 4,72 | 2,28 |
Из обычных растворителей наивысшей диэлектрической проницаемостью
обладает вода. Ее диэлектрическая проницаемость равна 78,3. Поэтому в ней молекулы
растворяемого (растворенного) вещества диссоциируют на ионы.
Диэлектрические проницаемости таких растворителей, хлороформ, бензол,
петролейный эфир (смесь углеводородов), в которых не происходит практически диссоциация, очень малы
В случае полярных молекул ( например, галогенводороды НХ) распад молекул на ионы происходит при взаимодействии с полярными молекулами растворителя.
Образование растворов электролитов приводит к уменьшению растворимости в них нейтральных молекул, например, растворимость газообразного хлора Сl2 в воде при 20 оС и 1 атм составляет 2 – 3 литра в 1000 г воды, а в 26 %-м растворе NaCl раствори-
мость хлора понижается до 300 мл в 1000 г раствора.
Необходимым условием, определяющим возможность процесса электролитической диссоциации, является наличие в растворяемом веществе ионных или полярных связей, а также достаточная полярность самого растворителя. Количественная оценка процесса электролитической диссоциации дается двумя величинами: степенью диссоциации α и константой диссоциации K.
Для количественной характеристики соотношения диссоциированных и
недиссоциированных молекул растворенного вещества при данных условиях
используют понятие степень диссоциации. Обозначают ее, обычно, буквой
«α». Степень диссоциации ─ это доля распавшихся молекул
Дата добавления: 2021-03-18; просмотров: 459;











