Прибор для определения осмотического давления.
Явление самопроизвольного перехода растворителя через полупроницаемую перегородку в раствор называется осмосом. Через некоторое время объем раствора в части В увеличится и его уровень поднимется выше уровня растворителя в части А на высоту П.
В результате увеличения объема раствора в части В возникает гидростатическое давление, называемое осмотическим давлением, которое количественно оценивается высотой П подъема жидкости в части В.
Процесс перехода растворителя в раствор самопроизволен, но обратный процесс самопроизвольно осуществляться не может, и для разделения раствора на растворитель и растворенное вещество следует затратить работу. Если в части В с раствором увеличить давление, то растворитель будет переходить в обратном направлении через мембрану в часть А. Этот процесс называется обратным осмосом, его используют для опреснения морской воды (Рис. 1.2.).
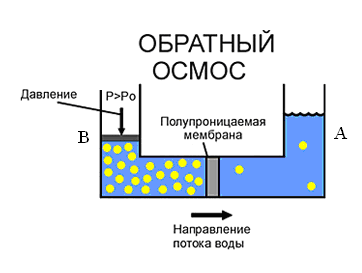
Рис.1.2. Обратный осмос
Осмотическое давление зависит от концентрации растворенного вещества и температуры. Так, при увеличении концентрации с сахарозы в воде в два раза осмотическое давление возрастает примерно в два раза, при увеличении концентрации c в три раза осмотическое давление возрастает почти во столько же и т. д. Это можно записать следующим образом: П ~ с, где с – мольная (молярная) концентрация.
При повышении температуры на один градус осмотическое давление возрастает на 1/273 часть своего первоначального значения. При повышении температуры на 10 градусов осмотическое давление возрастает на 10/273 и т. д. При повышении температуры Т (в К ) в два раза осмотическое давление возрастает также в 2 раза. Таким образом, выполняется зависимость: ПОСМ. ~ Т.
Объединяя обе зависимости (от концентрации и температуры) и вводя коэффициент пропорциональности R, получаем:
ПОСМ. = R∙с∙Т.
Для нахождения численного значения R подставим в эту формулу значения осмотического давления , концентрации с и температуры Т для одного из опытов. Так, при концентрации сахарозы 0,01 моль/л и температуре 0 °С (273 К) осмотическое давление составило 22 700 Па, поэтому
R = ПОСМ. /(С∙Т) = 22 700/(0,01•273) = 8315 Па•л/(К•моль).
Этот результат интересен тем, что он показывает удивительную взаимосвязь и взаимозависимость явлений природы. Мы нашли, что численное значение коэффициента пропорциональности R в выражении осмотического давления совпадает со значением универсальной газовой постоянной (8314 Па•л/К•моль).
Из этого следует, что осмотическое давление раствора, содержащего 1 моль/л сахарозы (глюкозы С6Н12О6, глицерина СН2ОНСНОНСН2ОН, этилового спирта С2Н5ОН, карбамида СО(NН2)2 или любого другого неэлектролита), равно 2 270 000 Па (22,4 атм), а осмотическое давление раствора, в котором на 22,4 л приходится 1 моль сахарозы, составит 101 325 Па (1 атм). Следовательно, при Т = 273 К и ПОСМ. = 101 325 Па (нормальные условия) раствор, содержащий 1 моль сахарозы, должен занимать объем 22,4 л. Этот пример иллюстрирует аналогию между поведением вещества в растворенном и газообразном состояниях.
Осмотическое давление равно тому давлению, которое оказывало бы растворенное вещество, если бы оно, находясь в газообразном состоянии при данной температуре, занимало тот же объем, который занимает раствор (закон и уравнение Вант-Гоффа).
РПОСМ. = СМRT
Таким образом, величина осмотического давления раствора пропорциональна концентрации (молярной) растворенного в нем вещества.
C учетом того, что СМ = n/V получаем:
РПОСМ. = nRT/V или РПОСМ. V = nRT.
Полученное уравнение по форме напоминает уравнение состояния идеального газа Клапейрона – Менделеева.
Каждое из четырех коллигативных свойств может использоваться для экспериментального определения молекулярной массы растворенного вещества. Зная массу вещества, взятого для приготовления раствора, и найдя из коллигативных свойств его молярную, моляльную концентрацию или мольную долю, можно отсюда вычислить молярную массу. Наибольшую точность обеспечивает измерение осмотического давления (хотя оно наиболее длительное, т.к. осмотическое равновесие устанавливается медленно).
Растворы, имеющие одинаковое осмотическое давление, называются изотоническими.Они содержат количество осмотически активных частиц.
Осмос и осмотическое давление имеют огромное значение в биологических явлениях, т. к. оболочки клеток биологических тканей являются полупроницаемыми перегородками.
Осмотическое давление клеточного сока растений изменяется от 2,0•105 Па (у болотных растений) до 4,5•106 Па (у степных). Вследствие осмоса вода и питательные растворы поднимаются из почвы по корням и далее по стволу растения на значительную высоту. Тканевые жидкости млекопитающих имеют осмотическое давление 6,7•105–8,1•105 Па. Осмотическое давление крови млекопитающих близко к осмотическому давлению океанской воды.
Осмотическое давление внутри живых клеток обусловливает прочность и упругость тканей, и благодаря ему осуществляется солевой обмен живой ткани с окружающей средой. Если раствор находится в замкнутом пространстве, например в клетке крови, то осмотическое давление может привести к разрыву клеточной мембраны. Именно по этой причине лекарства, предназначенные для введения в кровь, растворяют в изотоническом растворе, содержащем столько хлорида натрия (столовой соли), сколько нужно, чтобы уравновесить осмотическое давление, создаваемое клеточной жидкостью. Если бы вливаемые лекарственные препараты были изготовлены на воде, осмотическое давление, заставляя воду проникать в клетки крови, приводило бы к их разрыву. Если же ввести в кровь слишком концентрированный раствор хлорида натрия, то вода из клеток будет выходить наружу, и они сожмутся.
Даже небольшое изменение осмотического давления у человека вызывает
чувство дискомфорта. Например, чувство жажды после употребления соленой
пищи обусловлено потребностью организма: восстановить нормальное осмо-
тическое давление.
Животные или растительные клетки можно разрушить, если поместить их
в неизотонические растворы. Например, помещая эритроциты (красные кровя-
ные тельца) в дистиллированную воду, можно наблюдать, как вначале клетки
будут набухать, а затем разорвутся, и их содержимое вытечет в воду, окраши-
вая ее в красный цвет гемоглобином. В концентрированных растворах солей
будет отмечаться обратное явление – обезвоживание клеток, их сморщивание.
Кстати, это явление широко применяется для консервирования пищевых про-
дуктов с использованием больших концентраций соли или сахара.
В организме осмотическое давление должно быть постоянным (≈ 7,7 атм.). При болезнях больным вводят изотонические растворы. Это растворы, осмотическое давление которых равно π ПЛАЗМЫ ≈ 7,7 атм. (0,9 % NaCl – физиологический раствор, 5 % раствор глюкозы). Растворы, у которых π больше, чем у π ПЛАЗМЫ, называются гипертоническими. В медицине они применяются для очистки ран от гноя (10 % NaCl), для удаления аллергических оттенков (10 % CaCl2, 20 % – глюкоза), в качестве слабительных лекарств (Na2SO4∙10H2O, MgSO4∙7H2O). Растворы, у которых π меньше, чем у π ПЛАЗМЫ, называются гипотоническими.
Осмотическое давление разбавленного раствора (с < 0,01 моль/л) прямо пропорционально мольной концентрации растворенного вещества, т. е. пропорционально числу частиц, находящихся в данном объеме раствора. Свойства растворов, зависящие от числа частиц, называются коллигативными. К этим свойствам относятся понижение давления пара растворителя над раствором, повышение температуры кипения, понижение температуры замерзания. Все эти свойства пропорциональны числу растворенных частиц.
Дата добавления: 2021-03-18; просмотров: 523;











