И их соединений в периодической системе
Не только свойства элементов, но и их соединений находятся в периодической зависимости от радиуса атома и заряда ядра.
При рассмотрении свойств и форм соединений элементов часто пользуются упрощенной схемой, предложенной Косселем.
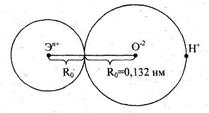
|
Она изображает группировку атомов Э-О-Н, где Э - атом элемента, О - атом кислорода, Н - атом водорода. Ионы Эn+ и О-2 представлены в виде сфер, радиусы которых соответствуют радиусам ионов. Направление диссоциации соединения, содержащую группировку атомов Э-О-Н, зависит от относительной прочности связей Э-О и О-Н.
Если прочнее связь Э-О, то при диссоциации разрывается связь О-Н и соединение выступает в роли кислоты. Если прочнее связь О-Н, то вещество ведет себя как основание. Если связи Э-О и О-Н приблизительно одинаковы, прочны, то соединение является амфотерным.
Согласно схеме Косселя увеличение степени окисления элемента и уменьшения радиуса иона элемента приводит к упрочнению связи Э-О и, следовательно, усилению кислотного характера соединения.
В периоде слева направо основной характер оксидов и гидроксидов постепенно ослабляется, переходя в амфотерный, а затем в кислотный, усиливающийся к концу периодов. Так, например, в ряду (III период) NaOH, Mg(OH)2, Al(OH)3, H2SiO3, H3PO4, H2SO4, HClO4 слева направо наблюдается усиление кислотных свойств гидроксидов.
Это отвечает и тому факту, что NaOH – сильное основание, Mg(OH)2 – основание средней силы, а Al(OH)3 –амфотерная гидроокись. Это объясняется уменьшением радиуса ионов слева направо в периоде, упрочнением связи Э-О и усилением кислотных свойств гидроксидов. Общий характер изменения остается и для других периодов.
В группах сверху вниз усиливается основной характер оксидов и гидроксидов и ослабевается кислотный характер, что объясняется увеличением радиуса ионов и ослаблением связи Э - О. Например, в группе 1 А все элементы образуют основные оксиды и гидроксиды, но наиболее резко основной характер выражен у элемента франция. Эта особенность проявляется и на химическом сродстве.
Атомы Си, Аg и Аи, составляющие побочную 1 Б подгруппу имеют также на внешнем уровне 1 электрон (ns1). Но однозарядные ионы этих металлов меньше ионов щелочных металлов. Поэтому у них связь Э - О прочнее, чем в соединениях главной подгруппы. Действительно, их гидроксиды – слабые основания.
Эта закономерность сохраняется по мере перехода к группам с большим номером, при этом возрастает отношение к проявлению различных степеней окисления. Для элементов, например, IV А группы характерны две степени окисления +2 и +4. При переходе от углерода к свинцу степень окисления +2 становится все более характерной, в связи, с чем растет и устойчивость веществ, содержащих Э2+. Для углерода и кремния степень окисления +2 проявляется в очень небольшом количестве соединений (CO, SiO); для них характерна степень окисления +4. Ge(OH)2, Sn(OH)2 и Pb(OH)2 – амфотерные соединения; их основные свойства усиливаются от Ge к Pb; у Pb(OH)2 преобладает основная ионизация, а у Ge(OH)2 – кислотная.
Так как 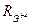 <
< 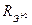 то связь Э+4 – О прочнее связи Э+2 – О. Поэтому содержащие группу Э+4 – О – Н проявляют кислотные свойства в большей степени. Углерод в степени +4 образует угольную кислоту Н2СО3, это очень слабая кислота. Еще более слабыми кислотами являются H2GeO3, H2SiO3, H2SnO3 и H2PbO3.
то связь Э+4 – О прочнее связи Э+2 – О. Поэтому содержащие группу Э+4 – О – Н проявляют кислотные свойства в большей степени. Углерод в степени +4 образует угольную кислоту Н2СО3, это очень слабая кислота. Еще более слабыми кислотами являются H2GeO3, H2SiO3, H2SnO3 и H2PbO3.
Для элементов IV группы (Ti, Zr, Hg) характерной степенью окисления также является +4. Соединения Э(ОН)4 – амфотерны, их кислотные свойства при переходе от титана к гафнию ослабевают.
Для элементов VI группы характерной является степень окисления +6.
В ряду H2SO4, H2SeO4, H2TeO4 слева направо R- ионов растет, связь Э – О ослабевает, и усиливаются основные свойства гидроксидов. Поэтому наиболее сильной кислотой является серная.
Изменение кислотно-основных свойств оксидов в зависимости от степени окисления можно показать на примере одного элемента, так в ряду MnO – Mn2O3 – MnO2 – MnO3 – Mn2O7 основные свойства ослабевают.
Связь Э – О с увеличением степени окисления упрочняется, и таким образом, усиливаются кислотные свойства гидроксидов.
Оксиду MnO соответствует основание, MnO2 проявляет амфотерные свойства, как и его гидроксид – Mn(OH)4 или H2MnO3, а оксиды MnO3 и Mn2O7 проявляют кислотные свойства и им соответствуют кислоты H2MnO4 и HMnO4.
Следует отметить, что рассмотренная выше закономерность изменения кислотно-основных свойств оксидов и гидроксидов наиболее полно проявляется у элементов главных подгрупп; у элементов Б подгрупп она иногда осложняется влиянием побочных факторов.
Приведенные выше данные подтверждают периодичность изменения свойств элементов и их соединений. Периодический закон, таким образом, свел накопленный химиками прошлого огромный, но разнообразный фактический материал в строгую систему. Процесс упорядочения полученных наукой сведений на основе периодического закона интенсивно происходит и в настоящее время.
Периодический закон и периодическая система является основой современной неорганической химии. Они относятся к числу таких общих научных закономерностей, которые реально существуют в природе и поэтому в процессе эволюции наших знаний никогда не потеряют своего значения.
Дата добавления: 2016-12-09; просмотров: 2809;











