Особенности молекулярного строения жидкостей
Жидкость занимает по свойствам и строению промежуточное положение между газами и твердыми кристаллическими веществами. Поэтому обладает свойствами как газообразных, так и твердых веществ. В молекулярно-кинетической теории различные агрегатные состояния вещества связывают с различной степенью упорядоченности молекул. Для твердых тел наблюдается так называемый дальний порядок в расположении частиц, т.е. их упорядоченное расположение, повторяющееся на больших расстояниях. В жидкостях имеет место так называемый ближний порядок в расположении частиц, т.е. их упорядоченное расположение, повторяющееся на расстояниях, сравнимы с межатомными. При температурах, близких к температуре кристаллизации, структура жидкости близка к твердому телу. При высоких температурах, близких к температуре кипения, структура жидкости соответствует газообразному состоянию – практически все молекулы участвуют в хаотическом тепловом движении.
Жидкости, подобно твердым телам, обладают определенным объемом, а подобно газам, принимают форму сосуда, в котором они находятся. Молекулы газа практически не связаны между собой силами межмолекулярного взаимодействия, и в данном случае средняя энергия теплового движения молекул газа гораздо больше средней потенциальной энергии, обусловленной силами притяжения между ними, поэтому молекулы газа разлетаются в разные стороны и газ занимает предоставленный ему объем. В твердых и жидких телах силы притяжения между молекулами уже существенны и удерживают молекулы на определенном расстоянии друг от друга. В этом случае средняя энергия теплового движения молекул меньше средней потенциальной энергии, обусловленной силами межмолекулярного взаимодействия, и ее недостаточно для преодоления сил притяжения между молекулами, поэтому твердые тела и жидкости имеют определенный объем.
Давление в жидкостях с увеличением температуры и уменьшением объема возрастает весьма резко. Объемное расширение жидкостей гораздо меньше, чем паров и газов, так как более значительны силы, связывающие молекулы в жидкости; то же замечание касается теплового расширения.
Теплоемкости жидкостей обычно растут с температурой (хотя и незначительно). Отношение Ср/СV практически равно единице.
Теория жидкости до настоящего времени полностью не развита. Разработка ряда проблем в исследовании сложных свойств жидкости принадлежит Я.И. Френкелю (1894–1952). Тепловое движение в жидкости он объяснял тем, что каждая молекула в течение некоторого времени колеблется около определенного положения равновесия, после чего скачком переходит в новое положение, отстоящее от исходного на расстоянии порядка межатомного. Таким образом, молекулы жидкости довольно медленно перемещаются по всей массе жидкости. С повышением температуры жидкости частота колебательного движения резко увеличивается, возрастает подвижность молекул.
На основе модели Френкеля можно объяснить некоторые отличительные особенности свойств жидкости. Так, жидкости даже вблизи критической температуры обладают гораздо большей вязкостью, чем газы, и вязкость с ростом температуры уменьшается (а не растет, как у газов). Объясняется это иным характером процесса передачи импульса: он передается молекулами, совершающими перескок из одного равновесного состояния в другое, а эти перескоки с ростом температуры существенно учащаются. Диффузия в жидкостях происходит только за счет перескоков молекул, и она происходит гораздо медленнее, чем в газах. Теплопроводность жидкостей обусловлена обменом кинетической энергии между частицами, колеблющимися около своих положений равновесия с различными амплитудами; резкие перескоки молекул заметной роли не играют. Механизм теплопроводности похож на механизм ее в газах. Характерной особенностью жидкости является ее способность иметь свободную поверхность (не ограниченную твердыми стенками).
Было предложено несколько теорий молекулярного строения жидкостей.
1. Зонная модель. В данный момент времени жидкость можно рассматривать как состоящую из областей, где молекулы расположены в правильном порядке, образуя своего рода микрокристалл (зона). Эти области как бы разделены веществом, находящимся в газообразном состоянии. С течением времени эти области образуются в других местах и т.д.
2. Теория квазикристаллического строения.Рассмотрим кристалл, находящийся при абсолютном нуле температуры (см. рис.9.9.)
 |
Выделим в нем произвольное направление и построим график зависимости вероятности Р нахождения молекулы газа на некотором расстоянии от другой молекулы, помещенной в начале координат (рис. 9.9. а), при этом молекулы находятся в узлах кристаллической решетки. При более высокой температуре (рис.9.9, б) молекулы колеблются вокруг неподвижных положений равновесия, вблизи которых и проводят большую часть времени. Строгая периодичность повторения максимумов вероятности в идеальном кристалле распространяется сколь угодно далеко от выбранной частицы; поэтому принято говорить, что в твердом теле существует «дальний порядок».
В случае жидкости (рис.9.9, в) вблизи каждой молекулы ее соседки расположены более или менее закономерно, но вдали этот порядок нарушается (ближний порядок). На графике расстояния измерены в долях радиуса молекулы (r/r0).
3. Термодинамическая модель. В этой теории вводят величину - радиальная функция распределения - представляющая собой вероятность обнаружить некоторую пару атомов на расстоянии от R до R+dR
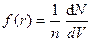 ,
,
где 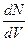 можно рассматривать как некоторую «локальную концентрацию молекул на расстоянии r от «избранной»: следовательно, радиальная функция распределения f(R) равна отношению концентраций: «локальной» жидкости.
можно рассматривать как некоторую «локальную концентрацию молекул на расстоянии r от «избранной»: следовательно, радиальная функция распределения f(R) равна отношению концентраций: «локальной» жидкости.
Дата добавления: 2016-12-09; просмотров: 3527;











