Реакция окисления углерода
Окисление углерода, растворенного в расплавах на основе железа, имеет наибольшее практическое значение в современной металлургии стали. Во всех случаях, начиная с плавки в кислородных конверторах с использованием скрапа и кончая "переплавом" в дуговых печах, приходится увязывать значения средних концентраций углерода в шихте с тем временем, которое необходимо для полного расплавления скрапа, формирования гомогенного шлака и нагрева металлической ванны до температуры, необходимой для ее раскисления, легирования и успешной разливки. В течение всего этого времени из газовой фазы в металл непрерывно поступает кислород и, для предотвращения его накопления в металле, поддержания [О] на относительно низком уровне и уменьшения угара металла в шлак, необходимо присутствие в металле дешевого и имеющего высокое сродство к кислороду элемента. Почти всегда таким элементом является углерод. При [C]³0,2 % углерод строго контролирует концентрацию кислорода, остающегося в растворе в металле, и в этом отношении является необходимым элементом.
Однако этим далеко не исчерпывается полезная роль углерода. Дело в том, что углерод является единственным элементом металлической ванны, дающим в обычных условиях плавки газообразные продукты окисления – {СО} -или, при низких [C], смеси {СО} и {СО2}. Выделение этих газообразных продуктов также играет огромную практическую роль. Оно, как известно, определяет: интенсивность перемешивания расплавленного металла и, следовательно, скорость выравнивания его состава и протекающих в нем химических взаимодействий, а также скорость теплопереноса внутри металла, т.е. скорость прогрева и выравнивания температуры металла во всем его объеме. Зарождение и всплывание в объеме металлов пузырьков СО способствует частичному переходу в них, в соответствии с законом Генри, растворенных в металле водорода и азота. Кроме того, всплывание пузырьков {CО} облегчает флотирование на них взвешенных в металле неметаллических включений и ассимиляцию их шлаком.
Все эти хорошо известные особенности реакции окисления углерода послужили причиной проведения большого количества работ по ее исследованию. Ниже мы приводим исследования этой реакции, проведенные методами "висящей"и "падающей капли". Условия этих исследований лучше всего совпадают с условиями рафинирования металлических капель, находящихся в реакционной зоне, образуемой кислородным дутьем (рис. 2).
Как видно из рис. 2, при содержаниях углерода выше 0,3¸0,7% скорость процесса обезуглероживания V[C] остается постоянной во времени независимо от [C], но она зависит от объемного расхода кислорода и от температуры металла (рис. 3). Было исследовано обезуглероживание сплавов с исходным содержанием углерода 4,55-4,4 % и начальными температурами 1550, 1500 и I650 °C. Во всех случаях, при [C]>0,7 % скорость обезуглероживания описывается кинетическим уравнением нулевого порядка по углероду, а именно:
W[C]=d[C]/dt. (27)
Используя "метод коротких интервалов" [28] для случая реакции нулевого порядка константа скорости для последовательных пар экспериментальных точек определяется уравнением:
ki,j=(Ci-Cj)/Dti,j, (28)
где Ci - начальная концентрация элемента "С" для данного отрезка времени Dti,j;
Cj – конечная концентрация тогоже элемента.
Многочисленные опыты по искусственной турбулизации, в частности, по использованию пульсирующего потока кислорода, позволяют считать, что в этих условиях ведущим звеном процесса обезуглероживания металла является внешний масcоперенос, т.е. поступление кислорода через толщу потока газа и неперемешиваемый слой его на поверхность металлической капли. Об этом, в частности, свидетельствует очень низкое значение энергии активации процесса (19,5-22,0 кДж/моль).
В диапазоне концентраций углерода от 0,5 до 0,7 %, определяемом изменениями внешних условий, существует так называемая переходная область процесса окисления углерода, где на его протекание оказывают существенное влияние как внешне-, так и внутридиффузионные процессы. При более низких содержаниях углерода в металле его окисление протекает уже по иному режиму.
Прежде всего, скорость окисления углерода уже не остается постоянной во времени, но является функцией текущей концентрации углерода. Эта зависимость выражается уравнениями:
d[C]/dt= –k[C] (29)
т.е. lg[C]= –(k/2,303)t+A (30)
или, согласно [28]:
ki,j=(2,303/Dti,j) lg[Ci]/[Cj]. (31)
Следовательно, в этих пределах концентраций углерода его окисление протекает как реакция первого порядка (по углероду), скорость которой определяется массопереносом углерода к тем участкам объема металла, где возможно или "наиболее выгодно" образование оксида углерода. Экспериментально найденная энергия активации процесса окисления углерода при этих низких его концентрациях составляет I6000-I8500 кал/моль (67,0-77,5 кДж/моль).
Определенный интерес представляют кривые, характеризующие кинетику поглощения металлом кислорода, полученные также с помощью "бестигельной" плавки металла [27] рис. 4б. Как видно из рисунка, при высоких концентрациях углерода, т.е. при "внешнедиффузионном" режиме лимитирования скорости его окисления, кислород почти не поглощается металлом и все его количество, поступающее на поверхность металла во всем диапазоне скоростей потока, расходуется на образование окcида углерода. Только при достижении значений [C] порядка 0,5-0,8 %, концентрация кислорода в металле начинает увеличиваться по мере дальнейшего окисления углерода. Это также свидетельствует о том, что при высоком содержании углерода процесс его окисления протекает в области лимитирования внешним массопереносом, а при низких значениях [C] он определяется внутренним массопереносом.
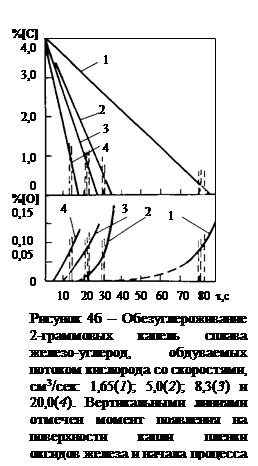
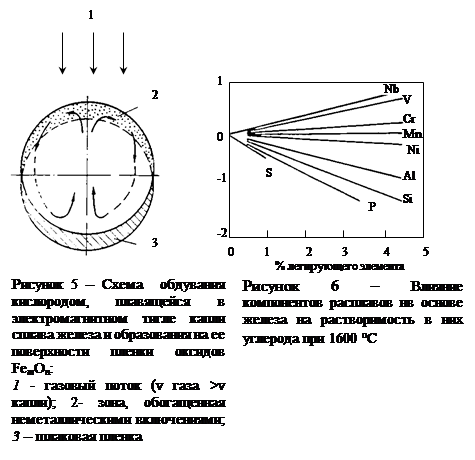
Изменение характера и кинетики окисления углерода по мере протекания процесса обезуглероживания внешне также хорошо проявляется. Во-первых, в период, когда ведущим звеном процесса является внешний массоперенос, образование шлаковой пленки, т.е.пленки оксидов FemOn почти не имеет места. Шлаковая пленка интенсивно образуется и скапливается на нижней поверхности капли (рис. 5) уже при переходе процесса в режим его лимитирования внутренним массопереносом. Во-вторых, вследствие постепенного переноса реакции окисления углерода с поверхности контакта металл-газ в объем металлической капли, происходит разбрызгивание металла выделяющимися из него пузырьками оксида углерода и, наконец, полное разрушение капли.
Описанная схема протекания процесса обезуглероживания ближе всего отражает уловия рафинирования металлических капель с высоким содержанием углерода, взвешенных в реакционной зоне конвертеров или интенсивно продуваемых подовых агрегатов.
При низких концентрациях углерода, т.е. при протекании процесса обезуглероживания в области лимитирования его внутренним массопереносом, происходит постепенное обогащение металла кислородом и достижение необходимых для гомогенного зарождения пузырьков оксида углерода сверхравновесных значений m=[% C][% O]на все более глубоком от поверхности металла уровне. Таким образом, процесс постепенно переходит в чисто "диффузионный" по кислороду.
Такое положение имеет, например, место в ставших очень актуальными случаях производства ряда легированных сталей с очень низкими концентрациями углерода (0,01-0,03 %), когда концентрация кислорода в поверхностных слоях металла достигает равновесия с кислородной атмосферой:
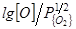 =6100/T+0,1245, (32)
=6100/T+0,1245, (32)
т.е. здесь 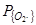 выражено в атмосферах (кг/м2). Уравнение справедливо при очень низких значениях
выражено в атмосферах (кг/м2). Уравнение справедливо при очень низких значениях 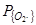 (до 0,01 ат или 1 кПа) и даже при
(до 0,01 ат или 1 кПа) и даже при 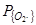 =1 ат (или 100 кПа).На поверхности металла образуется слой оксидов железа FenOm. В связи с этим ряд авторов [66, 67, 71, 76, 75, 95, 103], исследовавших рафинирование по углероду, справедливо описывают этот процесс как двухстадийный, состоящий из:
=1 ат (или 100 кПа).На поверхности металла образуется слой оксидов железа FenOm. В связи с этим ряд авторов [66, 67, 71, 76, 75, 95, 103], исследовавших рафинирование по углероду, справедливо описывают этот процесс как двухстадийный, состоящий из:
1) окисления железа кислородом и
2) окисления углерода за счет забрасывания в объем металла мельчайших оксидных (шлаковых) капель.
Естественно, что в зависимости от общего запаса углерода в шихте и от окончательных концентраций углерода в металле, температурных и гидродинамических условий продуваемой металлической ванны роль реакционной зоны в процессах рафинирования различна.
По данным ряда исследований процессов производства обычных углеродистых сталей [30, 34, 74] приблизительно вычислена доля углерода, окисляемого в реакционной зоне, от общего количества углерода, выгорающего за время плавки. Она составляет:
1) для конвертеров с верхней кислородной продувкой от 60 до 90 %;
2) для двухванных печей от 50 до 70 %;
3) для мартеновских печей от 20 до 50 %;
4) для дуговых печей от 10 до 30 %.
При наличии в металлической ванне шлакообразующих компонентов (Si, Mn, Cr, P и др.), в особенности при низких температурах, при которых изобарно-изотермический потенциал образования (SiO2), (MnO) и т.д. значительно ниже, чем для{СО} процесс окисления углерода значительно усложняется. В частности, даже при высоком содержании углерода его окисление переходит в режим внутреннего массопереноса или же осуществляется как двухстадийный процесс за счет активного кислорода в шлаке.
Термодинамика окисления углерода, находящегося в расплавах на основе железа исследована достаточно хорошо. Растворимость углерода в расплавленном железе в зависимости от температуры определяется уравнением (29):
[C]=1,34+2,54×10-3t (°C), (33)
или более точно формулой (27):
lgNC=(–560/T)–0,374. (34)
В реальных сплавах железа, в особенности в его легированных сплавах, растворимость углерода существенно меняется при каждой постоянной температуре [31] (см. таблицу 2 и рис. 6).
Таблица 2 – Влияние отдельных элементов на растворимость углерода в железе и параметры взаимодействия первого порядка с ними углерода
| Элемент | °С | D[%C]/D[% x] | ¶lgNC/¶Nx | eC=dlgf[C]/d[% x] |
| Al | –0,25 | –2,7 | 0,043 | |
| Cr | +0,09 | +1,3 | –0,024 | |
| Cu | –0,20 | –0,4 | 0,016 | |
| Mn | +0,04 | +0,5 | –0,012 | |
| Ni | –0,07 | –0,5 | 0,012 | |
| Nb | +0,12 | –0,06 | ||
| P | –0,35 | –4,6 | 0,051 | |
| S | –0,40 | –5,2 | 0,046 | |
| Si | –0,30 | –3,7 | 0,080 | |
| V | +0,13 | +2,2 | –0,077 | |
| Ti | +0,17 | +3,3 | – |
Если за стандартное состояние принять 1 процентный раствор углерода в железе (или низколегированных его сплавах), то для наиболее часто встречающихся в производстве сталей, концентрации углерода [C]=0,02-1,5 % можно, с допустимой для практики точностью, принять, что коэффициент активности углерода F[C]»1 и, следовательно, его активность a[C]»[SC].
Для вычисления активности углерода в многокомпонентных сплавах на основе железа приходится применять уравнение вида:
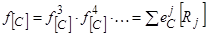 , (35)
, (35)
где 3, 4 и т.д. – другие, кроме железа и углерода, компоненты сплава и, таким образом, использовать термодинамику Вагнера и таблицы (32, 33, 69), определяющие параметры взаимодействия первого и второго порядка для углерода и других компонентов расплава на основе железа при 1600 °С или рассчитывать их значения при других температурах. На практике в подавляющем большинстве случаев учет присутствия компонентов, сильно влияющих на растворимость углерода в железе и на его активность в растворах в железе, не нужен вследствие малых значений концентраций этих элементов. Поэтому ниже рассматривается только термодинамика сплавов Fе-С-O.
При непосредственном взаимодействии кислорода с металлом, содержащим углерод, в особенности при высоких его концентрациях, когда процесс протекает по режиму лимитирования его внешним массопереносом, основное количество углерода окисляется на межфазной поверхности металл-газ. Однако одновременно в той или иной мере протекает окисление самого железа и растворение в нем кислорода. Значение этого явления существенно возрастает при понижении концентрации углерода и при переходе процесса в режим лимитирования внутренним массопереносом. Поэтому, говоря о термодинамике окисления углерода надо рассматривать следующие реакции:
1. [C]+1/2{O2}={CO}
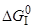 =152,64–0,034T, кДж/моль
=152,64–0,034T, кДж/моль
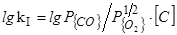 =(7960/T)+1,77 (36)
=(7960/T)+1,77 (36)
2. [C]+{O2}={CO2}
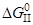 = –435,47–0,053T, кДж/моль
= –435,47–0,053T, кДж/моль
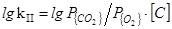 =(22510/T)+2,64 (37)
=(22510/T)+2,64 (37)
3. 1/2{O2}=[O]
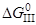 = –116,94–0,0024T, кДж/моль
= –116,94–0,0024T, кДж/моль
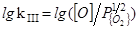 =(6100/T)+0,12 (38)
=(6100/T)+0,12 (38)
4. Feж+1/2{O2}=(FeO)
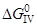 = –237,95–0,05T, кДж/моль
= –237,95–0,05T, кДж/моль
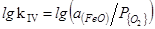 =(6320/T)+2,734 (39)
=(6320/T)+2,734 (39)
5. [C]+[O]={CO}
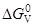 = –36,63–0,0031T, кДж/моль
= –36,63–0,0031T, кДж/моль
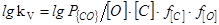 =(1860/T)+1,643 (40)
=(1860/T)+1,643 (40)
Рассмотрение термодинамических данных показывает, что на контактной поверхности металл-газ при обычных для сталеплавильных процессов условиях (T, 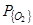 , [C]) окисление углерода может протекать как до CO так и до СО2. Соотношение
, [C]) окисление углерода может протекать как до CO так и до СО2. Соотношение 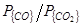 , в условиях равновесия определяется в основном температурой, а в условиях реакционной зоны сталеплавильных агрегатов – главным образом степенью развития межфазной поверхности и массопереносом, в зависимости от [C], либо в газовой, либо в металлической фазах.
, в условиях равновесия определяется в основном температурой, а в условиях реакционной зоны сталеплавильных агрегатов – главным образом степенью развития межфазной поверхности и массопереносом, в зависимости от [C], либо в газовой, либо в металлической фазах.
Растворение кислорода в металле происходит по реакции ½{O2}=[O] до тех, определяемых температурой металла, значений концентрации [O], при которых достигается пересыщение металла, т.е. протекают процессы образования новой фазы:
Feж+[O]=(FeO),
или Feж+1/2{O2}=(FeO)
Оба эти процесса возможны лишь при низких концентрациях углерода, когда реакция (40) практически не имеет места. Именно в этих условиях (при [C]£0,1 %) происходит окисление углерода не только до СО, но и до СО2, причем отношение 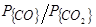 в равновесных условиях определяется не только температурой, но и значением [C] Как видно из уравнения для константы равновесия реакции, в условиях равновесия
в равновесных условиях определяется не только температурой, но и значением [C] Как видно из уравнения для константы равновесия реакции, в условиях равновесия
lg[C][O]×f[C]×f[O]–lgP{CO}=(–1860/T)–1,643, (41)
т.е. при f[C]=f[O]=1, при P{CO}=100 кПа и при T=1875 K,
[C]×[O]=0,0022. (42)
В связи с очень малым изменением энтальпии системы при протекании реакции (5} (даже знак ее -положительный или отрицательный -был различным по данным отдельных исследований) константа равновесия этой реакции и величина произведения [C]×[O] практически не зависит от температуры.
Поэтому среди металлургов получили широкое распространение хорошо проверенные на практике уравнения:
Вачера и Гамильтона
[SC]×[SO]=0,0025 (43)
и Ниллеса
[SC]×[SO]=0,00212+0,85 (44)
Все эти данные говорят о том, что в обычных условиях плавки углерод представляет собой элемент, определяющий концентрацию растворенного в металле кислорода и лишь при [% C]<0,05¸0,07 % наблюдаемые значения [% O]
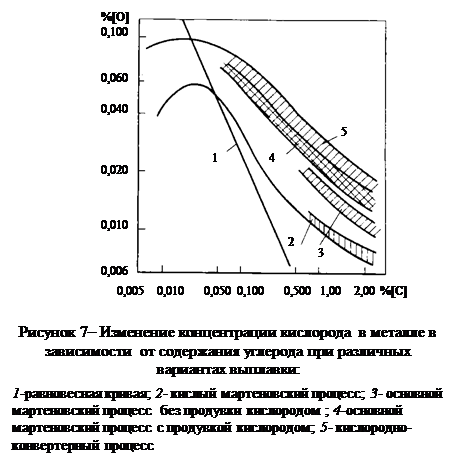
определяются уже не углеродом, а активностью окслидов железа в шлаковом покрове или парциальным давлением кислорода в газовой фазе [34] (рис. 7)
2.5 Физические процессы,
определяющие скорости гетерогенных реакций
В связи с большим практическим значением окислительного рафинирования на примерах именно этих реакций лучше всего рассмотреть вопрос о влиянии на их скорость отдельных физических процессов.
Дата добавления: 2016-11-26; просмотров: 3462;











