Окислительные процессы в многокомпонентных расплавах на основе железа
Окисление многокомпонентных расплавов на основе железа имеет место в большинстве промышленных способов производства стали, поэтому оно представляет особый практический интерес. Весьма значителен и чисто научный интерес таких вопросов, как участие в шлакообразовании отдельных компонентов расплава и их взаимная роль как составных компонентов формирующихся шлаков, соотношение скоростей окисления отдельных компонентов металлического расплава, распределение между ними кислорода, вступающего в контакт с металлом, последовательность окисления отдельных элементов многокомпонентного сплава и ряд других вопросов, имеющих различные ответы в зависимости от разных частных обстоятельств.
2.8 Соотношение скоростей окисления отдельных
компонентов расплавов на основе железа
Вопрос об относительных скоростях окисления отдельных компонентов чугунов, перерабатываемых в бессемеровских и томасовских конвертерах был впервые рассмотрен и, для того времени, весьма удачно решен М.М. Карнауховым [51] в 1923 году. М.М. Карнаухов считал, что "относительные скорости" окисления отдельных компонентов чугунов, а значит, и последовательность их окисления и их защитная роль по отношению друг к другу определяются чисто термодинамическим параметром – упругостью диссоциации оксида, образуемого тем или иным элементом. Он не настаивал на точных математических связях, считал, что имеются отчетливые качественные связи:
VC:VMn:VSi:VP= 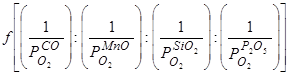 , (62)
, (62)
где значения упругости диссоциации оксидов относятся к реакциям растворенного в металле компонента с образованием его в растворе в шлаковой, или в газовой фазах. Например, для кремния:
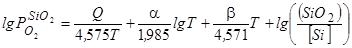 (63)
(63)
Саму величину упругости диссоциации оксида М.М. Карнаухов рассчитывал через константу равновесия процесса образования оксида (например, [Si]+O2газ=(SiO2) используя экспериментальные данные о (SiO2) и [Si] и применяя упрощенную формулу Нернста [51]:
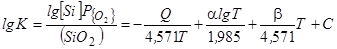 , (64)
, (64)
где Q – энтальпия рассматриваемой реакции,
Т – температура (К),
a и b – постоянные коэффициенты в эмпирических выражениях для определения теплоемкости реагирующих веществ;
C – постоянная интегрирования (для кислорода С=2,8).
Хотя вынужденные допущения М.М. Карнаухова, конечно, не имеют строгой научной основы, чисто качественно они хорошо описывали процессы окислительного рафинирования и широко применялись металлургами на протяжении ряда лет.
2.9 Роль поверхностной активности компонентов
расплавов на основе железа
В современных условиях в связи со все возрастающими потребностями интенсификации процессов рафинирования металла, главным образом за счет резкого увеличения удельной поверхности контакта его с извлекающими примеси фазами (газом, шлаком и т.д.), очень обострилась необходимость подробного рассмотрения и детального изучения самого акта перехода атомов растворенных в металле элементов в поверхностный слой металла на его границе с контактирующими с ним фазами. В связи с этим возрос и интерес к вопросу о влиянии поверхностной активности компонентов металлических расплавов на скорости процессов их рафинирования и о возможностях управления относительными скоростями, а, значит, о последовательности удаления из металла отдельных компонентов расплава.
Значительные успехи науки в области изучения поверхностных явлений вообще и, в частности, в металлургии, позволяют сейчас дать некоторые уточнения и в кинетику окислительного рафинирования многокомпонентных сплавов железа. Впервые этот вопрос был рассмотрен В.И. Явойским и А.Ф. Вишкаревым [52] Позднее С.И. Попель и В.В. Павлов [53, 54] дали подробную количественную оценку влиянию адсорбции отдельных компонентов сплавов железа на кинетику их рафинирования.
Компоненты расплава, заключающиеся в каждом элементарном его объеме, стремятся к равновесному распределению в объеме и в поверхностном слое. "Поверхностное сгущение" компонента (или его адсорбция – Г) определяется уравнением:
Г=([A]об/RT)(ds/d[A]об). (65)
Мгновенное значение концентрации рассматриваемого компонента в поверхностном слое определится уравнением:
[А]мгн.пов.=[А]об+ 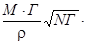 100 %, (66)
100 %, (66)
где [А]об – концентрация данного элемента в объеме раствора;
[А]мгн.пов – его поверхностная концентрация;
N – число Авогадро;
r – плотность расплава;
M – атомный вес адсорбируемого компонента;
s – поверхностное натяжение расплава.
В условиях контакта металла с окислительной газовой фазой значение мгновенной поверхностной концентрации любого компонента расплава в общем случае является функцией ряда переменных:
[А]мгн.пов=f([A]об×DA×WA×ГA), (67)
где DA – коэффициент диффузии (в частности, молекулярной) компонента А в расплавленном металле, определяющий снабжение поверхностного слоя компонентом А,
WА – скорость окисления элемента А на поверхности расплавленного металла, определяемая окислительным потенциалом газовой фазы и скоростью массопереноса в ней окислителя к поверхности металла.
[А]мгн.пов→0 при высоком окислительном потенциале газа или при низких значениях [А]об. В связи с относительно малым значением массы металла, составляющей его поверхностный слой, склонность отдельных элементов к адсорбции может иметь практическое значение только при очень большом значении величины удельной поверхности контакта металл-газ, т.е. при мелкодиспергированной металлической фазе.
Исходя из этих соображений С.И. Попель и др. [54] вывели следующее соотношение для скоростей окисления шлакообразующих элементов металлической ванны:
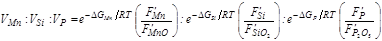 (68)
(68)
где ΔGMn, ΔGSi и ΔGP – изобарно-изотермические потенциалы окисления марганца, кремния и фосфора;
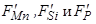 – константы, характеризующие поверхностную активность марганца, кремния и фосфора;
– константы, характеризующие поверхностную активность марганца, кремния и фосфора;
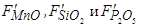 – константы, характеризующие поверхностную активность оксидов MnO, SiO2 и P2O5 в образующихся шлаковых расплавах.
– константы, характеризующие поверхностную активность оксидов MnO, SiO2 и P2O5 в образующихся шлаковых расплавах.
Из приведенного уравнения следует, что относительные скорости окисления примесей металла определяются их сродством к кислороду (DG) и поверхностными активностями. При заданных составах металла и шлака тот или иной компонент окисляется тем быстрее, чем больше его сродство к кислороду (т.е. чем более отрицательно значение DG), чем больше его капиллярная активность в металле и чем меньше капиллярная активность оксида этого элемента в шлаке.
Эти уточнения кинетики процессов окислительного рафинирования пока не получили широкого распространения, т.к. обычно кинетические кривые, достроенные для той или иной плавки с учетом способностей отдельных элементов к адсорбции мало отличаются от рассчитанных по М.М. Карнаухову с учетом только величины сродства элемента к кислороду при данных условиях. С чисто научных позиций использование сведений о поверхностной активности элементов (констант F΄Mn, F΄Si и т.д.), а также о поверхностной активности оксидов этих элементов в шлаках (констант F΄MnO и т.д.) нельзя считать строгим, т.к. все они являются константами, характеризующими равновесное распределение элемента или его оксида между объемом и поверхностным слоем металла или шлака и, следовательно, не описывают кинетику процесса перехода атомов элемента из объема металла в поверхностный слой или оксида в поверхностный слой шлака. Тем не менее можно привести также ряд примеров отчетливо выраженного влияния поверхностной активности отдельных элементов на практику окислительного рафинирования в современных условиях, некоторые из них приведены ниже.
Окисление серы
Одним из примеров отчетливого влияния адсорбционных процессов на окислительное рафинирование является переход некоторой части растворенной в чугунах серы в газовую фазу в форме SO2 при продувке ванны кислородом. Упругость диссоциации SO2 при температурах конвертерного процесса настолько велика даже по сравнению с упругостью диссоциации FеО (не говоря уже об упругости диссоциации оксидов других компонентов передельных чугунов), что окисление серы никак нельзя описать исходя только из термодинамических соображений [61].
Однако практика некоторых заводов Юга, на которых перерабатываются чугуны, не прошедшие предварительную десульфурацию, т.е. содержащие 0,04¸0,08 %S, показала пагубное влияние так называемой "сульфидной коррозии" на металлические части газоотводящей системы – каминов, клапанов, котлов-утилизаторов и т.д. Например, балансы, характеризующие распределение серы при плавках в 150-тонном конвертере, несмотря на их неточность и несовершенство в условиях работающего цеха, показали, что при среднем содержании серы в шихте 0,075 %, т.е. при весе =11,25 кг в металле остается 5,96 кг (около 0,041 %). При весе шлака 12,4 т и содержании в нем S =0,37, в него перешло 4,575 кг серы. Таким образом, с газовой фазой из конвертера унесено: 11,25-5,695-4,545=1,015 кг серы, что составляет около 18 % от всего количества серы, теряемого шихтой в процессе плавки. Аналогичные результаты получены С.Г. Афанасьевым и др. в опытах на Криворожском металлургическом заводе.
Термодинамически непредсказуемое окисление серы исследователи объясняют по разному. В работах С.И. Филиппова [75] и С.И. Попеля [88] показано, что максимальная адсорбция серы в жидком железе наблюдается при ее концентрации в объеме: [S]=0,06¸0,08 %. По расчетам С.И. Попеля в этом случае химический состав поверхностного адсорбционного слоя приближается к сульфиду железа FeS, т.е. концентрация серы достигает ~30 %. В таком случае избыточная, по сравнению с объемной, концентрация серы в поверхностном слое металлического расплава, отвечающая максимальному значению адсорбции серы и равновесному парциальному давлению ее в газовой фазе составляет 15×10–10 моль/см2 [57] т.е. тоже весьма велика.
В последние годы была исследована совместная поверхностная активность кислорода и серы в тройных сплавах Fe-О-S. Так, например, в работе [57] для [O]£0,016% и [S]£0,3¸1,0 % дано уравнение, описывающее значение поверхностного натяжения:
s=1910–825(1+[% O])–540lg(1+[% S])H/м (69)
и установлено, что площадь оккупирования на поверхности Fe-S-О атомами S и O меньше, чем в случае присутствия одной лишь серы.
Следовательно, в присутствии кислорода в поверхностном слое металла концентрация серы должна быть существенно ниже, чем при ее максимальной адсорбции в чистом сплаве Fe-S, должна зависеть от [O] в этом слое, но, тем не менее, адсорбция серы и в присутствии кислорода реально существует.
В. Слободник [64], изучавший удаление серы из металла в окислительную газовую фазу, с помощью бестигельной плавки, высказал предположение, что сера испаряется с поверхности металлических капель и, уже находясь в газовой фазе, окисляется до SO2. Естественно, что для полного отрицания этого механизма удаления серы нет оснований, однако, учитывая малую способность серы к испарению из сильно разбавленных растворов в железе (до сотых долей процента) [61, 85, 86] он едва ли получает сколько-нибудь значительное развитие. Намного вероятней, что в условиях реакционной зоны, т.е. при огромном избытке кислорода и чрезвычайно развитой межфазной поверхности газ-металл имеет место полное и одновременное окисление всех атомов, находящихся в поверхностном слое металла, в том числе и адсорбированных в нем атомов серы [55].
Деванадация
Другой пример, показывающий необходимость учета роли поверхностной активности компонентов металлических расплавов, подвергаемых окислительному рафинированию, представляет собой первый этап дуплекс-процесса при переделе ванадийсодержащих чугунов. Задача этого этапа дуплекс-процесса конвертер-конвертер заключается по возможности в полном извлечении ванадия в шлак и обеспечении для второго этапа процесса полупродукта, содержащего 2,8-3,6 % [C] при температуре t³I400 °С. Поскольку конечное содержание ванадия в полупродукте должно быть 0,01-0,05 %, то, естественно, что процесс деванадации заканчивается в режиме внутреннего массопереноса.
Элементарные подсчеты показывают, что в этих условиях упругость диссоциации СО на несколько порядков ниже, чем упругость диссоциации V2О3 и, если принимать во внимание только этот чисто термодинамический показатель, то скорость обезуглероживания металла должна быть существенно выше, чем скорость деванадации. Если же принимать во внимание способность углерода и ванадия к адсорбции на поверхности контакта металл-газ, то здесь необходимы следующие уточнения: оба эти элемента поверхностно-инактивны в расплавах Fе-С и Fе-V, но, как показала работа [86] в сплавах Fе-С-V ванадий обладает некоторой поверхностной активностью, скорее всего за счет вытеснения из объема в поверхностный слой металла группировок V-С. При этом при температурах 1550-1450 °C поверхностная концентрация ванадия в 2-4 раза выше равновесной с ней объемной концентрации [V]. На практике, в условиях реакционной зоны при очень развитой поверхности контакта металл-газ и наличии локальных объемов с избытком кислорода, поверхностное окисление ванадия приводит к ощутимым значениям скорости понижения его объемной концентрации. Чем больше величина удельной поверхности контакта металл-газ, тем, при прочих равных условиях, выше будут скорости деванадации металла, и тем ниже будут остаточные концентрации ванадия при том же конечном содержании углерода ([C]=2,75-3,6 %) и прочих равных условиях.
Особенно отчетливо это подтверждено при использовании пульсирующего кислородного дутья, которое, при той же номинальной интенсивности продувки (2-3 нм3/т.мин), но при частоте пульсаций газа ~500 Гц обеспечивает:
1) увеличение в реакционной зоне поверхности контакта металл-газ как минимум на 25-30 %,
2) за счет вибрирования и перемешивания поверхностных слоев капель металла, обусловленных пульсациями газа, более чем вдвое увеличивается интенсивность смены локальных участков поверхности металла.
В итоге, вместо типичных для обычной продувки концентраций ванадия в полупродукте (в конце первого этапа дуплекс-процесса [V]=0,03¸0,06 %) при пульсирующем с оптимальной частотой дутье в полупродукте устойчиво достигаются [V]=0,01¸0,02 %. В настоящее время пульсирующее кислородное дутье внедрено в технологическую практику работы НТМК.
Учет влияния поверхностной активности отдельных компонентов комплексных сплавов особенно плодотворен в таких случаях, как, например, конвертерное производство весьма низкоуглеродистой (в частности, трансформаторной) стали, при выплавке АОД-процессом низкоуглеродистых аустенитных хромоникелевых нержавеющих сталей и др.
Таким образом, в современных условиях, при расширяющемся сортаменте сталей, производимых преимущественно с использованием окислительного рафинирования, необходимо учитывать поверхностные свойства компонентов перерабатываемой шихты. В ряде случаев это облегчает достижение заданных служебных свойств готового металла.
2.12 Гипотеза о ведущей роли
адсорбционно-кинетического звена
процессов окислительного рафинирования
Появление в черной металлургии новых промышленных вариантов окислительного рафинирования, например, вакуумного обезуглероживания железоуглеродистых и легированных расплавов заставило металлургов провести углубленные исследования этих реакций при изменяющихся в широких пределах внешних условий протекания процесса [34, 68].
Ряд металлургов [64-68] разработали теорию, в соответствии с которой при определенных внешних условиях ведущим звеном в процессах окислительного рафинирования является адсорбция кислорода на поверхности расплавленного металла и следующее за ней химическое взаимодействие адсорбированных атомов кислорода с компонентами металлического расплава. Особое внимание было уделено изучению кинетики окисления углерода, главным образом при обдувании металла газовыми смесями (O2+N2 и O2+Ar) с широко изменяемыми парциальными давлениями кислорода. Вышеупомянутые авторы считали, что вследствие использования различных новых методов интенсификации процессов массопереноса кислорода и окисляемых компонентов в объеме металла, скорости массопередачи в расплаве и тем более в газовой фазе слишком велики, чтобы эти процессы могли быть ведущим звеном окисления примесей металла.
Таким образом, привычному для металлургов представлению об огромном превосходстве скоростей химических реакций над скоростями чисто физических процессов при температурах, характерных для сталеплавильного производства, противопоставлено обратное положение. Ниже приведены наиболее интересные результаты опытов и отдельных теоретических расчетов вышеупомянутых авторов.
Например, процесс обезуглероживания металла рассматривается как состоящий из последовательных стадий[64]
1) Диффузия кислорода в газовой фазе к поверхности металла
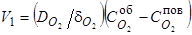 (70)
(70)
2) Адсорбция его поверхностным слоем расплава
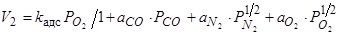 (71)
(71)
где kадс – константа скорости процесса адсорбции кислорода,
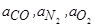 – адсорбционные коэффициенты газов CO, N2, O2;
– адсорбционные коэффициенты газов CO, N2, O2;
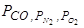 – парциальные давления газов CO, N2, O2;
– парциальные давления газов CO, N2, O2;
3) Диффузия углерода в металле к поверхности металла
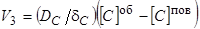 (72)
(72)
4) Химическая реакция
V4=k[C]пов×[C]адс (73)
5) Десорбция оксида углерода с поверхности металла:
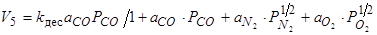 (74)
(74)
где kдес – константа скорости десорбции СО.
6) Удаление оксида углерода в объеме газа
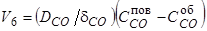 (75)
(75)
 Авторы работы [64] считают, что из этих стадий процесса наиболее медленной, а следовательно ведущей, является вторая. В доказательство приводятся результаты экспериментов по продувке углеродистых расплавов смесями газов O2+N2 и O2+Ar (рис. 13). Из рис. 13 видно, что скорость процесса сильно изменяется с температурой. Кажущаяся энергия активации составляет Е=27 ккал/моль (113 кДж/моль), что намного превышает значения Е, характерные для процессов массопереноса.
Авторы работы [64] считают, что из этих стадий процесса наиболее медленной, а следовательно ведущей, является вторая. В доказательство приводятся результаты экспериментов по продувке углеродистых расплавов смесями газов O2+N2 и O2+Ar (рис. 13). Из рис. 13 видно, что скорость процесса сильно изменяется с температурой. Кажущаяся энергия активации составляет Е=27 ккал/моль (113 кДж/моль), что намного превышает значения Е, характерные для процессов массопереноса.
При замене аргона азотом (при постоянном 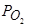 ) скорость процесса при всех температурах понижается, а его энергия активации увеличивается до Е=36,7 ккал/моль (153 кДж/моль). Если допустить лимитирование реакции окисления углерода диссоциацией молекул кислорода газовой фазы и адсорбцией атомов кислорода, то необходимо учесть, что, хотя кислород и является наиболее поверхностно-активным элементом, он не единственный элемент, обладающий этим свойством. Поэтому активность кислорода на поверхности металла (аO) определяется уравнением:
) скорость процесса при всех температурах понижается, а его энергия активации увеличивается до Е=36,7 ккал/моль (153 кДж/моль). Если допустить лимитирование реакции окисления углерода диссоциацией молекул кислорода газовой фазы и адсорбцией атомов кислорода, то необходимо учесть, что, хотя кислород и является наиболее поверхностно-активным элементом, он не единственный элемент, обладающий этим свойством. Поэтому активность кислорода на поверхности металла (аO) определяется уравнением:
aO=kO(qO/1-qO) (76)
где qO – доля активных мест (активных центров) поверхности металла, занятых атомами кислорода,
kO – коэффициент пропорциональности.
Следовательно, присутствие таких, хотя и менее поверхностно-активных по сравнению с кислородом, атомов, занимающих определенную часть поверхностных центров (например, азот (рис. 13) [68] или сера (рис. 14), должно уменьшить qO и отрицательно повлиять на величину скорости обезуглероживания.
Количество адсорбционно-активных центров на поверхности металла ограничено и при определенных условиях должно иметь место полное насыщение их кислородом, поэтому зависимость между скоростью окисления углерода и парциальным давлением кислорода или скоростью поступления кислорода должна иметь различный характер в областях низких и высоких 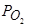 (или при разном содержании кислорода в продуваемом газе).
(или при разном содержании кислорода в продуваемом газе).
При низких парциальных давлениях кислорода или при малых скоростях поступления кислорода справедлива следующая зависимость:
–d[% C]/dt=k(1–q) 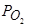 (77)
(77)
где q – доля центров адсорбции на поверхности металла, свободных от кислорода и других поверхностно-активных элементов.
Экспериментальные доказательства справедливости предположения о ведущей роли адсорбционно-кинетического звена в окислительных процессах нельзя признать полными и безупречными. Однако некоторые из них следует здесь привести.
При низких парциальных давлениях кислорода должны иметь место:
1. Значительное изменение константы скорости реакции [C]+1/2{O2}={CO} с температурой (рис. 13).
2. Прямая пропорциональность между давлением кислорода и скоростью обезуглероживания (рис.13, 14).
3. Независимость d[C]/dt от концентрации углерода.
4. Зависимость d[C]/dt от присутствия других (кроме кислорода) поверхностно-активных элементов (рис.13, 14).
5. Независимость d[C]/dt от скорости потока окисляющей газовой смеси (рис.16).
При повышенных парциальных давлениях кислорода, как отмечают сами авторы гипотезы о ведущей роли адсорбционно-кинетического звена, большинство из этих положений не проявляется (см. например, рис.15 и 16). Степень заполнения адсорбционно-активных центров кислородом и другими поверхностно-активными компонентами зависит от ряда условий и трудно определима экспериментально. Поэтому деление опытных данных на относящиеся к низким и высоким парциальным давлениям кислорода представляется весьма условным. Таким образом, трудно определить, приемлемы ли вышеперечисленные положения к тем или иным конкретным условиям.

 В работах [67, 68] высказано предположение о том, что при высоких
В работах [67, 68] высказано предположение о том, что при высоких 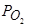 происходит процесс окисления железа и последующее за этим очень быстрое распределение FеО в объеме металла (плавка в индукционной печи) и химическая реакция (FeO)+[C]=Feж+COгаз. По мнению этих авторов признаками такого хода процесса должны быть:
происходит процесс окисления железа и последующее за этим очень быстрое распределение FеО в объеме металла (плавка в индукционной печи) и химическая реакция (FeO)+[C]=Feж+COгаз. По мнению этих авторов признаками такого хода процесса должны быть:
1. Независимость скорости процесса обезуглероживания от скорости потока окислительного газа.
2. Большое значение энергии активации процесса – 20 ¸100 ккал/моль (83-420 кДж/молъ).
3. Поверхностно-активные элементы например, сера или азот, должны оказывать замедляющее воздействие на процесс обезуглероживания.
Результаты опытных данных [45, 48, 63, 75] говорят о том, что преимущественное окисление поверхностного слоя атомов железа и перенос группировок Fе-O в объем металла, сопровождаемые окислением углерода уже в объеме металла, возможны только при низких концентрациях углерода (ниже 0,5¸0,3 %). Значит, предположение Гхоши и Сена [67, 68] может быть справедливым только в ограниченных условиях, определенных низкими концентрациями углерода.
Наибольшие возражения вызывает утверждение сторонников адсорбционно-кинетической теории окислительного рафинирования о больших значениях энергии активации процесса в частности, процесса окисления углерода, позволившее выдвинуть самое гипотезу о ведущей роли адсорбции кислорода. В ряде хорошо экспериментально оснащенных исследований это не было подтверждено [55, 71]. Таким образом, следует признать:
1. Оригинальность и теоретический интерес гипотезы о ведущей роли адсорбционно-кинетического звена в процессе окислительного рафинирования расплавов на основе железа.
2. Относительно слабое экспериментальное подтверждение этой гипотезы при использовании обычных методов лабораторных металлургических исследований и необходимость изыскания новых, более точных и надежных методов обнаружения и оценки особенностей процесса, способных доказать справедливость гипотезы.
3. Зависимости, подтверждающие рассматриваемую гипотезу проявляются, по опытным данным самих ее сторонников, лишь при некоторых ограниченных условиях:
а) значительное влияние температуры на Vс наблюдалось лишь в температурном интервале t=I550-I700 °C (рис. 17);

 б) прямая пропорциональная зависимость Vс от
б) прямая пропорциональная зависимость Vс от 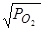 , подтверждающая ведущую роль диссоциации молекул кислорода, ощущается только в пределах
, подтверждающая ведущую роль диссоциации молекул кислорода, ощущается только в пределах 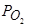 от 0 до 0,02 мПа;
от 0 до 0,02 мПа;
в) влияние такого поверхностно-активного компонента как сера на величину Vс исследовано только при значениях 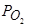 от 0 до 0,025 мПа.
от 0 до 0,025 мПа.
4. Металлургов в первую очередь интересуют условия протекания окислительных процессов в реакционных зонах различных сталеплавильных агрегатов. Эти условия резко отличаются от исследованных сторонниками рассматриваемой гипотезы: в реакционной зоне наблюдаются температуры от 1800 до 2300 °С, при которых диссоциация молекул кислорода в контакте с расплавленным железом несколько облегчается, но резко понижается способность металла к адсорбции. Поэтому роль и кинетика поглощения кислорода в этих условиях остается совершенно неясной.
Абсолютные величины парциальных давлений кислорода также совершенно отличны от исследованных в рассматриваемых работах. Еще слабее гипотеза о ведущей роли адсорбционно-кинетического звена в процессах окисления подтверждена на примерах удаления из металла шлакообразующих компонентов. Авторы гипотезы не провели надежную проверку ее в промышленных условиях и естественно, не выработали каких-либо рекомендаций по интенсификации и оптимизации процессов окислительного рафинирования в промышленных агрегатах.
Поэтому, допуская в принципе ведущую роль адсорбционно-кинетического звена в отдельных частных случаях, авторы считают более правильным и надежным анализировать процессы рафинирования металла в промышленных агрегатах, используя законы массопереноса, учитывая их влияние на кинетику гетерогенных реакций. Основные положения для этого изложены в предыдущих главах.
Дата добавления: 2016-11-26; просмотров: 1824;











