Практический тепловой баланс
Практический тепловой баланс в общем случае определяется простым уравнением
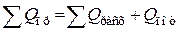 ,
,
где Qпр– физическое тепло, вносимое в аппарат реагентами, материалом аппарата (для периодических процессов), тепло фазовых переходов, тепло реакции и т. д.;
Qрасх – физическое тепло, уносимое из аппарата продуктами реакции;
Qпот – тепло, теряемое в окружающую среду.
При неизвестных размерах аппарата точное определение величин тепла, теряемого в окружающую среду, невозможно. В этом случае принимают Qпот равным 3-5 % от максимального значения суммы вносимого или уносимого тепла. Если геометрические размеры аппарата известны, то можно оценить потери тепла по уравнению теплоотдачи

где Q – поток потерянного тепла, Вт;
F– наружная поверхность теплообмена аппарата, кв.м;
aп – наружный коэффициент теплоотдачи, Вт/(кв.м·К);
tп – температура наружной поверхности аппарата, °С;
tо – температура окружающей среды, °С.
Температура наружной поверхности аппарата либо определяется из санитарных условий (<50 °С), либо задается условиями работы аппарата. Температура окружающей среды выбирается минимальной для данного помещения или района (при установке оборудования на открытом воздухе). Наружный коэффициент теплоотдачи рассчитывается по двум составляющим:
aн = aк + aл,
где aк – коэффициент теплоотдачи конвекцией;
aл – коэффициент теплоотдачи лучеиспусканием.
Конвективный коэффициент теплоотдачи зависит от места установки оборудования и от его положения в пространстве.
Горизонтальные трубопроводы и оборудование внутри помещений: при 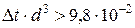
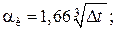
при 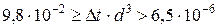
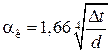 ,
,
где d – наружный диаметр аппарата.
Для вертикальных аппаратов и трубопроводов внутри помещения:
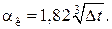
При установке оборудования на открытом воздухе:
– для плоских стенок
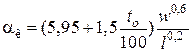 ,
,
где w – скорость ветра, м/с;
l – длина стенки по направлению ветра, м;
– для аппаратов
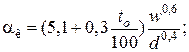
– для горизонтальных трубопроводов
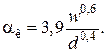
Коэффициент теплоотдачи лучеиспусканием (температура в К)
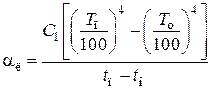 ,
,
где C1 – степень черноты поверхности аппарата или трубопровода.
В случае расчета теплоизоляции аппарата или трубопровода, величина Q будет допустимой потерей тепла в окружающую среду. Тогда толщину слоя теплоизоляции можно рассчитать по формуле
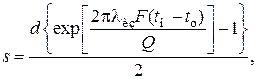
где lиз – коэффициент теплопроводности материала изоляции.
Рассмотрим расчет теплового баланса на примере.
Пример 9.2. Определить температуру реакционной смеси процесса окисления метанола до формальдегида на входе в реактор, полагая температуру на выходе из реакционной зоны равной 800 °С. Результаты материальных расчетов взять из примера 4.3. Теплоемкости компонентов реакции принять средними при температуре 650 °С.
Решение: Определим теплоемкости компонентов процесса. Из справочника [18] выпишем стандартные энтальпии образования и температурные зависимости теплоемкостей всех веществ, участвующих в процессе.
Для всех реакций процесса рассчитаем энтальпию реакции:
реакция (1) –115,9-241,84+201,2+0,5·0=-156,54 кДж/моль;
реакция (2) -115,9-0+201,2=85,3 кДж/моль;
реакция (3) -110,5-2·0+201,2=126,35 кДж/моль;
реакция (4) -74,85-241,84+201,2=-115,49 кДж/моль;
реакция (5) -376,7-241,84+115,9=-502,64 кДж/моль;
реакция (6) -393,51-241,84+115,9+1,5·0=519,45 кДж/моль.
Тогда уравнения реакций с термохимическим правилом знаков (тепловой эффект в кДж/моль) примут вид:
CH3OH+1/2O2=CH2O+H2O+156,54; (1)
CH3OH=CH2O+H2-85,3; (2)
CH3OH=CO+2H2-126,35; (3)
CH3OH+H2=CH4+H2O+115,49; (4)
CH3OH+O2=HCOOH+H2O+502,64; (5)
CH3OH+1,5O2=CO2+2H2O-519,45. (6)
На основании материального баланса рассчитаем мольный расход метанола по каждой из реакций системы, а затем и количество выделяемого или поглощаемого тепла (см. табл. 9.2.), откуда тепловой эффект процесса будет равен 604,8 кВт.
Таблица 9.1. Энтальпии образования и температурные зависимости теплоемкости
| Компонент | DH0, кДж/моль | Теплоемкость, Дж/(моль·К) | |||
| a | b·103 | c·106 | c’·10-5 | ||
| Кислород | 31,46 | 3,30 | - | -3,77 | |
| Азот | 27,87 | 4,27 | - | - | |
| СО | -110,5 | 28,41 | 4,10 | - | -0,46 |
| СО2 | -393,51 | 44,14 | 9,04 | - | -8,53 |
| Водород | 27,28 | 3,26 | - | 0,502 | |
| Вода | -241,84 | 30,00 | 10,71 | - | 0,33 |
| Метанол | -201,2 | 15,28 | 105,2 | -31,04 | - |
| Метан | -74,85 | 17,45 | 60,46 | 1,117 | - |
| СН2О | -115,9 | 18,82 | 58,38 | -15,61 | - |
| НСООН | -376,7 | 19,4 | 112,8 | -47,5 | - |
Таблица 9.2. К расчету суммарного теплового эффекта процесса
| Номер реакции | Расход метанола, кмоль/ч | Тепло реакции, кДж/моль | Расход тепла, кВт |
| (1) | 23,95 | 156,54 | |
| (2) | 16,75 | -85,3 | -397 |
| (3) | 0,154 | -126,35 | 5,4 |
| (4) | 0,456 | 115,49 | -14,6 |
| (5) | 2,75 | 502,64 | -384 |
| (6) | 2,45 | -519,45 | |
| Итого: | 63,93 | 604,8 |
Таблица 9.3. Средние теплоемкости компонентов реакции
| Компонент | Теплоемкость, Дж/(моль·К) | Теплоемкость, Дж/(кг·К) |
| Кислород | 31,46 | |
| Азот | 27,87 | |
| СО | 28,41 | |
| СО2 | 44,14 | |
| Водород | 27,28 | |
| Вода | 30,00 | |
| Метанол | 15,28 | |
| Метан | 17,45 | |
| СН2О | 18,82 | |
| НСООН | 19,40 |
Составим тепловой баланс процесса окисления метанола, предварительно рассчитав теплоемкости .компонентов при заданной температуре 650°С по уравнениям
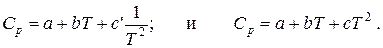
Данные расчета занесены в табл. 9.3.
Физическое тепло, вносимое компонентами в реактор:
с метанолом 1860·2,44·t/3600=1,2607·t кВт;
с кислородом 586·1,05·t/3600=0,1709·t кВт;
с азотом 1920·1,12·t/3600=0,5973·t кВт.
Всего на входе в реактор 2,0289·t кВт.
Таблица 9.4. Тепловой баланс процесса получения формальдегида
| ПРИХОД ТЕПЛА | РАСХОД ТЕПЛА | |||||
| Статьи | КВт | % | Статьи | КВт | % | |
| Спирто-воздушная смесь: Метанол Кислород Азот Тепло реации Ошибки округления | 650,5 88,2 308,2 604,8 0,2 | 39,38 5,34 18,66 36,61 0,01 | Формальдегид Метанол Водяной пар НСООН СО2 СО Метан Водород Азот Потери тепла | 493,4 201,7 207,7 47,8 27,1 1.1 6,6 109,9 477,9 78,7 | 29,87 12,21 12,57 2,89 1,64 0,07 0,40 6,65 28,93 4,77 | |
| ИТОГО: | 1651,9 | ИТОГО: | 1651,9 | |||
Физическое тепло, уносимое компонентами из реакционной зоны:
с формальдегидом 1220·1,82·800/3600=493,4 кВт;
с метанолом 372·2,44·800/3600=201,7 кВт;
с водяным паром 572·2,13·800/3600=207,7 кВт;
с уксусной кислотой 126,5·1,7·800/3600=47,8 кВт;
с диоксидом углерода 108·1,13·800/3600=27,1 кВт;
с оксидом углерода 4,3·1,13·800/3600=1,1 кВт;
с метаном 7,3·4,05·800/3600=6,6 кВт;
с водородом 34,1·14,5·800/3600=109,9 кВт;
с азотом 1920·1,12·800/3600=477,9 кВт;
Всего на выходе – 1573,2 кВт.
Примем потери тепла в количестве 5 % от его расхода. Составим уравнение теплового баланса, из которого определим температуру на входе в реактор:
2,0289·t+604,8=1573,2+0,05·1573,2.
t=(1,051573,2-604,8)/2,0289=516 °C.
Занесем результаты расчета в табл. 9.4.
Пример 9.3.Произвести тепловой расчет и составить тепловой баланс колонны синтеза аммиака в соответствии с исходными данными:
температура в зоне реакции t=500 °C;
количество газовой смеси на входе в колонну V1 =119025 нм3/ч;
температура газовой смеси на входе t1=35 °С;
количество газовой смеси на выходе из колонны V2 =102329 нм3/ч;
температура газовой смеси на выходе t2=110 °С.
Состав газовой смеси
| Компонент | Состав газовой смеси, % по объему | |
| на входе | на выходе | |
| Водород | 74,1 | 62,06 |
| Азот | 24,7 | 20,7 |
| Аммиак | 1,2 | 17,24 |
Количество образующегося аммиака GNH3=12500 кг/ч.
Рабочее давление в аппарате Pp=30 МПа.
Температура воды
на входе 200 °С;
на выходе 374 °С.
Решение. (Исходные данные и физико-химические свойства компонентов взяты из литературы [11, 49, 120].)
Составим уравнение теплового баланса
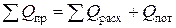 .
.
Приход тепла в колонну синтеза аммиака (SQпр).
1) С газовой смесью
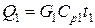 ,
,
где G1 – количество поступающей газовой смеси, кмоль/ч;
Ср1 – ее мольная теплоемкость, Ср1=31,0 кДж/(кмоль×К).
Откуда 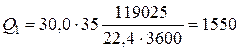 кВт.
кВт.
2) Тепловой эффект реакции синтеза аммиака при высоком давлении. Определяется по уравнению
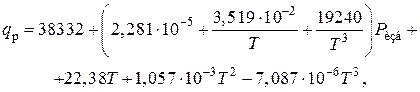
где qp – тепловой эффект реакции, кДж/кмоль;
Ризб – избыточное давление в реакторе, Па;
Т – температура, К.
В данном случае
Т=273+500=773 К;
Р=30×106 Па.
Откуда
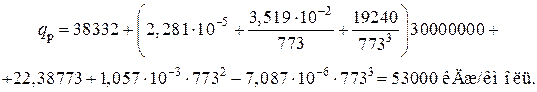
Общее количество тепла, выделяющееся при синтезе аммиака, будет
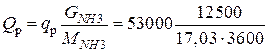 =10806 кВт.
=10806 кВт.
3) С охлаждающей водой на входе
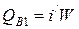 ,
,
где i/ - энтальпия воды на входе при температуре 200 °С, равная 853 кДж/кг;
W – расход охлаждающей воды, кг/с.
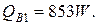
Общий приход тепла в колонну синтеза аммиака
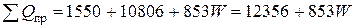 кВт.
кВт.
Расход тепла в колонне синтеза аммиака
1) Расход тепла, уносимого с газовым потоком, равен
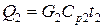 ,
,
где G2 – количество уходящей газовой смеси, кмоль/ч;
Ср2 – ее мольная теплоемкость, Ср2=33,1 кДж/(кмоль×К).
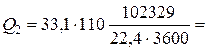 4620 кВт.
4620 кВт.
2) Тепло, уносимое охлаждающей водой,
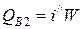 ,
,
где i// - энтальпия воды на выходе при температуре 374 °С, i//=2100 кДж/кг.
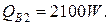
3) Потери тепла в окружающую среду можно принять равными 5 % от тепла, вносимого в колонну синтеза аммиака
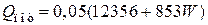 кВт.
кВт.
Общий расход тепла
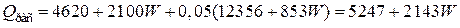 кВт.
кВт.
Уравнение теплового баланса
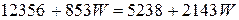 .
.
Откуда расход охлаждающей воды будет равен
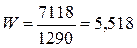 кг/с.
кг/с.
Составим таблицу теплового баланса (табл. 9.5).
Таблица 9.5. Тепловой баланс колонны синтеза аммиака
| Приход тепла | Расход тепла | ||
| Статьи прихода | кВт | Статьи расхода | кВт |
| Газовая смесь Реакция синтеза Охлаждающая вода | Газовая смесь Охлаждающая вода Потери тепла | ||
| Итого | Итого |
Дата добавления: 2021-02-19; просмотров: 609;











