Теплообмен в реакторах
При проведении реакции при постоянной температуре (изотермический процесс) степень превращения реагентов зависит от их концентрации и не зависит от температуры, поэтому уравнение материального баланса можно проинтегрировать и получить зависимость степени превращения от времени.
При неизотермическом проведении процесса (адиабатическом или программно регулируемом) приходится решать совместно уравнения материального и теплового баланса с учетом зависимости скорости реакции от температуры и, при необходимости, процесса теплопередачи.
Для создания приблизительно изотермических условий в реакторе можно применить несколько способов теплообмена:
- теплообмен при постоянной скорости теплопередачи; когда реактор обогревается топочными газами или пламенем, коэффициент теплопередачи изменяется мало, а температура настолько высока, что изменение температуры реагентов практически не влияет на температурный напор;
- теплообмен при постоянном коэффициенте теплопередачи; например, в аппаратах с мешалкой коэффициент теплопередачи зависит в основном от скорости перемешивания, которую можно держать постоянной, и скорость теплопередачи будет определяться изменением температуры реагентов;
- автоматическое регулирование скорости теплопередачи путем регулирования расхода теплоносителя или изменения температуры его фазового перехода, например за счет давления.
Последний способ, в принципе, является самым лучшим, но не всегда экономически целесообразным.
Теплообмен в реакторах смешения. Рассмотрим химическую реакцию
A+B=R+ΔHr,
где ΔHr – энтальпия реакции, Дж/моль.
Запишем уравнение теплового баланса, относя мольные энтальпии к некоторой температуре ТС, например 0 ºС, являющейся уровнем отсчета.
Начальная температура реагентов Т0, конечная – Т:
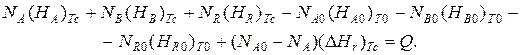
Q – количество отводимого или подводимого тепла, Дж.
Если отсутствуют фазовые превращения, то энтальпии компонентов можно выразить через теплоемкости:
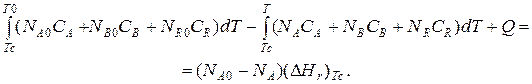
Если полагать, что теплоемкости не зависят от температуры в исследуемом интервале температур, а температура Т0 является уровнем отсчета, то уравнение упростится:
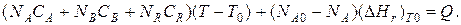
Зная состав исходной смеси, можно связать степень превращения и температуру. Для стехиометрической смеси, разделив последнее уравнение на NA0, получим:
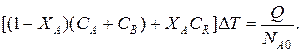
После преобразований
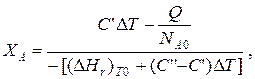
где С' и С'' – сумма теплоемкостей реагентов и продуктов реакции соответственно. Но, так как
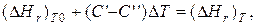
то
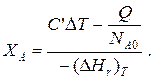
Здесь у энтальпии реакции и теплоты термодинамическое правило знаков,
т. е. тепло, подводимое к системе, считается положительным.
Для адиабатических условий Q=0, поэтому
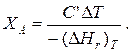
Пример 9.4. Для реакции первого порядка А+В=R, протекающей в адиабатических условиях, известны следующие данные: Т0=28 ºС; NA0=NB0=1 кмоль; NR0=0; СА=СВ=125 Дж/(моль·К); CR=167 Дж/(моль·К);
H= -11600 Дж/моль. Константа скорости реакции в узком интервале температур зависит линейно от температуры
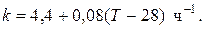
Определить степень превращения реагентов и время ее достижения, если температура в реакторе повысилась за счет реакции на 28 К?
Решение: Полагая отсутствие фазовых превращений в процессе, составим уравнение теплового баланса
[(1-XA)(125+125)+167XA](T - 28)-11600XA=0;
(250-83XA)(T-28)=11600XA;
T-28=28=11600XA/(250-83XA);
XA=0,503.
Определим время реакции из баланса массы при условии реакции первого порядка
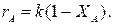
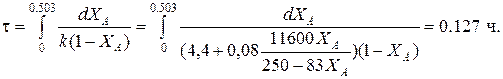
(Последний интеграл вычислен численным методом по формуле Симпсона.)
Составим тепловой баланс в дифференциальной форме, полагая, что за элементарное время dt скорость реакции rA и скорость теплопередачи R определяются уравнениями
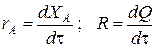 ;
;
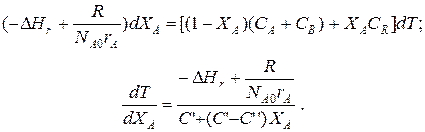
Теплоемкость и скорость реакции являются известными функциями температуры. Если скорость теплопередачи задана в функции от температуры, то последнее уравнение можно проинтегрировать. Для трех рассмотренных способов теплообмена связь между температурой и скоростью теплопередачи имеет вид:
- теплообмен при постоянной скорости теплопередачи
R=const;
- теплообмен при постоянном коэффициенте теплопередачи
R=KS(Tт-T), KS=const, Tт=const;
- автоматическое регулирование скорости теплопередачи
R=DHr·rA=KS(Tт-T), T=const.
Здесь: K – коэффициент теплопередачи, Вт/(м2*К);
S – поверхность теплопередачи, м2;
Tт – температура теплоносителя.
Пример 9.5. Для реакции первого порядка известны следующие данные: энтальпия реакции DHr=11600Дж/моль; константа скорости реакции k=0,8 ч-1; коэффициент теплопередачи К=51 Вт/(м2·К); начальная загрузка реагента NA0=2270 моль. Определить поверхность теплообмена, необходимую для поддержания постоянной температуры t=49 ºС до конечной степени превращения XA=70 %. Нагрев осуществляется паром, температуру которого Тт можно регулировать в пределах от 110 до 177 ºС.
Решение: Скорость подвода тепла должна быть наибольшей в начале процесса, когда ХА=0, а скорость реакции – наибольшая. Расчет будем производить, используя уравнение
DHr·rA=KS1(Tт-T).
Откуда максимальная поверхность теплопередачи в этот момент выразится уравнением
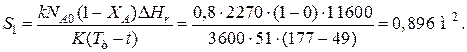
При такой поверхности и конечной степени превращения ХА=0.7 температура теплоносителя должна быть равна
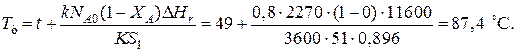
Эту температуру не обеспечить паром заданных параметров. Степень превращения, отвечающая наиболее низкой заданной температуре теплоносителя 110 ºС, при поверхности теплопередачи S1 составит
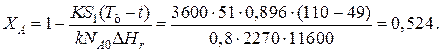
При температуре теплоносителя 110 ºС и степени превращения 0,7 имеем
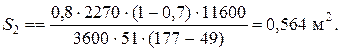
При ХА=0.524 и S2=0.564 м2 имеем
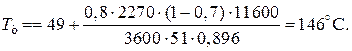
Таким образом, нагреватель должен состоять из двух параллельных змеевиков, один из которых с поверхностью S1=0,564 м2, а другой –
S2=0,896-0,564=0,332 м2. При снижении температуры пара до 110 ºС змеевик с поверхностью 0,332 м2 следует отключить.
Кривые регулирования строятся по уравнениям

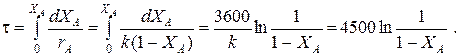
При ХА£0.52 ТТ=49+128(1-ХА);
при ХА>0.52 ТТ=49+203(1-ХА).
|
| Рис. 9.2. К расчету теплообмена в реакторе вытеснения |
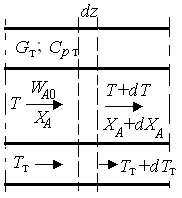
Теплообмен в реакторах вытеснения. Если полагать отсутствие в реакционной зоне реактора идеального вытеснения радиальных градиентов температур, то можно составить три уравнения, одно из которых – баланс массы, второе – баланс тепла по реакционной массе и третье – баланс тепла по теплоносителю. Схема тепло- и массообмена в элементе реактора представлена на рис. 9.2.
Уравнение баланса массы
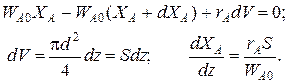
Уравнение баланса тепла в элементе реакционной зоны
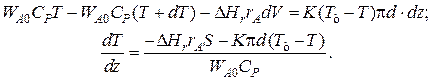
Уравнение баланса тепла в элементе рубашки
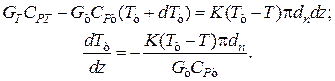
Совместное решение системы из трех дифференциальных уравнений дает возможность определить распределение степеней превращения, температур реакционной смеси и теплоносителя по длине реактора идеального вытеснения.
Для адиабатического реактора идеального вытеснения получаем систему из двух дифференциальных уравнений
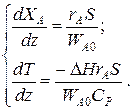
Пример 9.6. В гомогенном реакторе идеального вытеснения, представляющем собой трубу внутренним диаметром 50мм, протекает адиабатическая реакция второго порядка. Кинетические параметры реакции: энергия активации Е=58200 Дж/моль, k0=2·107 м3/(моль·ч). Начальная концентрация реагента 20 кмоль/м3, его мольный расход 60 кмоль/ч, теплоемкость реакционной смеси 125 Дж/(моль·К). Энтальпия реакции
DHr=-10000 Дж/моль. Определить длину реактора при 90 %-ной степени превращения, если начальная температура реагентов 77 ºС.
Решение: Подставим исходные данные в систему дифференциальных уравнений материального и теплового баланса адиабатического реактора:
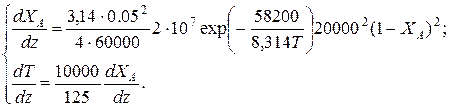
После преобразований получим:
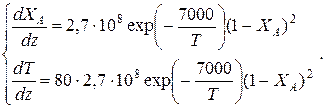
Таблица 9.6.Результаты решения дифференциального уравнения
| z, м | 0,0 | 0,2 | 0,4 | 0,6 | 0,8 | 1,0 | 1,2 | 1,3 |
| XA, % | 0,00 | 12,94 | 30,31 | 51,50 | 70,54 | 82,22 | 88,32 | 90,21 |
| T, K | 350,0 | 360,4 | 372,2 | 391,2 | 406,4 | 415,8 | 420,7 | 422,2 |
Решая полученную систему численным методом, можем найти длину реактора. Например, при решении модифицированным методом Эйлера при шаге интегрирования 0.02 м получаем длину реактора 1,3 м (см.
табл. 9.6).
Дата добавления: 2021-02-19; просмотров: 591;











