Определение бактерий группы кишечных палочек
Понятие «бактерии группы кишечных палочек» включает различных представителей семейства Enterobacteriaсеае: родов Escherichia, Citrobacter, Enterobacter, Klebsiella и др. По нормативной документации к БГКП относятся грамотрицательные, не образующие спор палочки, не обладающие оксидазной активностью, ферментирующие лактозу с образованием кислоты и газа при температуре 37°С в течение 5-24 ч (приложение Б, табл. 1). По международной классификации такие микроорганизмы относят к общим колиформным бактериям (ОКБ). Они попадают в окружающую среду, в том числе и в воду, с испражнениями человека и животных, поэтому обнаружение их свидетельствует о фекальном загрязнении и эпидемической опасности в отношении кишечных инфекций.
БГКП (ОКБ) можно определять двумя методами: методом мембранных фильтров и титрационным (бродильным) методом.
Исследование воды методом мембранных фильтров.
Метод основан на фильтрации установленного объема воды через мембранные фильтры, выращивании посевов на дифференциально-диагностической среде и последующей идентификации колоний по культуральным и биохимическим признакам.
Перед употреблением мембранные фильтры проверяют на отсутствие трещин, отверстий, пузырей и кипятят в дистиллированной воде в течение 10 мин (при этом нельзя допускать скручивания фильтров). Для полного удаления из фильтров остатков растворителей, которые применяются при их изготовлении, кипячение следует повторить 3-5 раз со сменой дистиллированной воды. Подготовленные таким образом фильтры сохраняются в банках с дистиллированной водой или в сухом виде. В день постановки опыта фильтры повторно стерилизуют кипячением в дистиллированной воде в течение 10 мин.
Фильтрование производят с помощью специальных приборов или фильтра Зейтца (рис. 5.3). Перед посевом воды аппарат стерилизуют фламбированием. После остывания на фильтровальный столик, на котором расположена сетка, стерильным пинцетом помещают мембранный фильтр, прижимают его воронкой или металлическим цилиндром и плотно закрепляют специальными винтами. Отросток колбы, в которую фильтруется вода, с помощью резиновой трубки соединяют с водоструйным или масляным насосом для создания вакуума в приемном сосуде (около 0,25 атм).
Объем воды для посева выбирают с учетом таблицы 5.3, он должен быть таким, чтобы на фильтре выросло не более 30 изолированных колоний. Рекомендуемый объем питьевой воды – 300 мл. Исследуемую воду каждого объема фильтруют не менее чем через 2 фильтра.
В воронку или стакан наливают необходимые объемы воды, начиная с меньших, а затем большие, каждый раз меняя фильтры. Самый меньший объем воды - 1 мл - следует фильтровать через фильтр, предварительно смоченный стерильной водой. После фильтрования верхнюю часть прибора снимают и фильтр осторожно (при сохранении вакуума для удаления излишка влаги на фильтре) стерильным пинцетом переносят на среду Эндо в чашку Петри. Фильтр накладывают вверх поверхностью, на которой осели бактерии, избегая появления пузырьков воздуха между фильтром и средой. На одну чашку можно разместить 4 фильтра, под каждым на дне чашки следует надписать объем воды, номер пробы и число. Если вода мутная, то фильтрование ведется сразу через два фильтра: предварительный фильтр № 6 (для задержания крупных частиц) помещают на фильтр № 2. После фильтрования оба фильтра переносят на среду Эндо. Чашки с фильтрами помещают в термостат и инкубируют при температуре 37°С в течение 24 ч. При окончательном результате учитывают колонии, выросшие на обоих фильтрах.
При наличии в воде БГКП (ОКБ) на фильтрах появляется рост типичных для этих бактерий колоний: темно-красные с металлическим блеском или красные, розовые с красным центром, имеющие четкий отпечаток на обратной стороне фильтра. Бактерии из таких колоний окрашивают по Граму и микроскопируют. Окраску по Граму можно заменить на тест Грегерсена (приложение Б). С культурой грамотрицательных бактерий лактозоположительных колоний ставят оксидазный тест (приложение Б) для дифференциации бактерий семейства Enterobacteriaceae от Pseudomonadaceae (последние являются оксидазообразующими бактериями). Оставшуюся часть оксидазоотрицательной Гр(-) изолированной колонии засевают в пробирку с полужидкой лактозной средой и инкубируют при 370С, 48 ч. При появлении кислоты и газа за более короткий промежуток времени, результат считают положительным.
Индекс ОКБ (БГКП) рассчитывают по формуле:
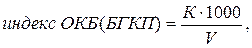
| (5.3) |
где К - количество проверенных на принадлежность к ОКБ (БГКП) колоний на фильтрах;
V - объем профильтрованной воды через фильтры, на которых велся учет.
Например, профильтровано по 100 мл в трех повторностях, на одном фильтре выросло 5 колоний, на другом - 2, на третьем - нет роста.
Индекс ОКБ будет равен: [(5 + 2) х 1000] : 300 = 23 КОЕ (колонийобразующих единиц). Для перевода индекса в титр используют формулу (5.1), для рассмотренного случая: Титр = 1000 : 23 = 43,5 мл. В соответствии с СанПиН, у воды питьевой индекс ОКБ должен быть не более 3.
Метод мембранных фильтров является современным, точным, менее трудоемким и более дешевым в сравнении с титрационным методом. Он удобен и тем, что позволяет концентрировать бактерии, содержащиеся в значительном объеме воды на небольшой поверхности фильтра. Однако одним из самых существенных недостатков метода является то, что этим методом выявляется меньшее количество бактерий в сравнении с титрационным. Для большей точности рекомендуется исследование воды проводить параллельно обеими методами.
Титрационный метод исследования воды.
Метод основан на накоплении бактерий после посева установленного объема воды в жидкую питательную среду, с последующим пересевом на дифференциально-диагностическую среду и идентификации колоний по культуральным и биохимическим тестам.
Объем засеваемой воды зависит от характера исследуемого объекта, но обязательно посев ведется в 2-3, а в некоторых случаях - в 5-ти повторностях.
Объемы воды выбирают с таким расчетом, чтобы в одном из разбавлении получить хотя бы один отрицательный результат .(табл. 5.4).
Посев воды производится в глюкозопептонную среду (ГПС): 100 мл воды - в 10 мл концентрированной среды, 50 мл - в 15 мл концентрированной среды, 10 мл - в 1 мл также концентрированной среды; 1 мл и последующие разведения - в 10 мл глюкозопептонной среды нормальной концентрации. Большие объемы воды засеваются во флаконы или колбы, меньшие - в пробирки. Посевы инкубируют в термостате в течение суток при температуре 37°С.
Таблица 5.4 - Схема посева воды из различных объектов при работе титрационным методом
| Объект исследования | Объемы засеваемой воды (в мл) для определения | |
| БГКП, ЛПК, Е. coli | энтерококков | |
| Вода питьевая централизованного водоснабжения | 3 повторности по 100,10, 1 | 2 или З повторности по 100, 10, 1 |
| Вода нецентрализованного водоснабжения и плавательных бассейнов | 50, 5 повторностей по 10, 1 или 2 повторности по 100, 10, 1 и 0,1 | 2 или З повторности по 100, 10, 1 |
| Водные объекты, не загрязняемые сточными водами | 50, 5 повторностей по 10, 1 или 2-3 повторности по 10; 1; 0,1; 0,01 | 50, 5 повторностей по 10, 1 или 2-3 повторности по 10; 1;0,1; 0,001 |
| Водоемы, загрязняемые сточными водами | 2-3 повторности по 1; 0,1; 0,01; 0,001 или 1; 0,1; 0,01; 0,001; 0,0001; 0,00001 | 2-3 повторности по 10; 1; 0,1; 0,01 |
| Сточные воды до очистки и обеззараживания | От 0,01 до 0,000000001 | От 0,1 до 0,00000001 |
| Сточные воды после очистки и обеззараживания | От 0,1 до 0,00000001 | От 0,1 до 0,000001 |
Из пробирок с посевами, в которых наблюдается помутнение (а также образование кислоты и газа), делают высев на сектора в чашки со средой Эндо. Посевы выдерживают в термостате при температуре 37°С в течение 16-18 ч. При наличии на среде Эндо характерных для БГКП (ОКБ) колоний (красных с металлическим блеском) следует провести все тесты, перечисленные выше. Положительный ответ на наличие БГКП дается в том случае, если наблюдается рост характерных колоний, образованных оксидазоотрицательными, Гр(-) бактериями, сбраживающих лактозу при 370С с образованием кислоты и газа. Обращают внимание также на отпечаток, окрашенный в красный цвет, на среде после снятия изучаемой колонии. Таким образом, положительный ответ выдается через 40-42 ч. Так же, как и при определении БГКП методом мембранных фильтров, если на среде Эндо выросли лактозоотрицательные колонии (розовые, бесцветные, мелкие красные), то их принадлежность к БГКП (ОКБ) подтверждается отрицательной окраской по Граму, отрицательным оксидазным тестом, способностью ферментировать лактозу до кислоты и газа при температуре 37°С и отсутствием протеолитической активности (при посеве на среду Эндо с молоком).
Результат выражается в виде индекса (титра) БГКП или ОКБ, цифровое выражение которых определяют по таблице 5.5.
Таблица 5.5 - Расчет наиболее вероятного числа бактерий в 1 л воды
| Число положительных результатов из 3 объемов | Индекс ОКБ (БГКП) | Титр ОКБ (БГКП) | Число положительных результатов из 3 объемов | Индекс ОКБ (БГКП) | Титр ОКБ (БГКП) | ||||
| по 100 мл | по 10 мл | по 1 мл | по 100 мл | по 10 мл | по 1 мл | ||||
| < 3 | > 333 | ||||||||
| 0,9 | |||||||||
| >1100 | <0,9 |
Определение термотолерантных колиформных бактерий (ТКБ)
Из всех бактерий, входящих в состав БГКП, наибольшее санитарно-показательное значение имеют микроорганизмы рода Escherichia. По способности расщеплять лактозу при температуре 37°С из БГКП (ОКБ) принято выделять Гр(-) бактерии, которые способны ферментировать лактозу при температуре 44,5°С. К ним относится Е. coli, не растущая на цитратной среде. В соответствии с международной классификацией эту группу бактерий называют термотолерантные колиформные бактерии - ТКБ.
Число ТКБ характеризует степень фекального загрязнения воды водных объектов и косвенно определяет эпидемическую опасность в отношении возбудителей кишечных инфекций. ТКБ определяют теми же методами, как и БГКП (ОКБ), кроме последнего этапа идентификации, который проводится по ферментации лактозы на полужидкой питательной среде при 44,5°С. В случае роста на среде Эндо типичных лактозоположительных колоний, Гр(-), оксидазоотрицательных, спсобных ферментировать лактозу при 44,50С, их учитывают как ТКБ, индекс или титр определяют по таблице 5.5.
Определение Е. coli
Определение Е.соlі является дополнительным показателем для расшифровки происхождения биологической контаминации, определения свежести фекального загрязнения, при оценке качества воды в случае превышения норматива. Такое исследование проводится при периодических анализах воды, а также при неожиданных изменениях в основных показателях - индекса ОКБ, ТКБ.
Группа бактерий, условно обозначаемых как Е.coli, включает лактозоположительные кишечные палочки, ферментирующие лактозу до кислоты и газа при температуре 43-44,5°С в присутствии ингибиторов посторонней микрофлоры и образующие индол при той же температуре. В основном это бактерии рода Escherichia, но могут быть отнесены в эту группу и представители других родов, обладающие такими же свойствами (например, Citrobacter и др.). Е. coli определяют теми же методами: мембранных фильтров, прямого посева и титрационным.
Различие - на этапе исследования свойств микроорганизмов, выросших на среде Эндо. Результат исследования выражают количеством Е. coli в 1 л (Coli-индекс).
Метод прямого посева применяется при определении Е. coli в сточных водах и сильно загрязненной воде водоемов. На чашки со средой Эндо засевают по 0,1-0,5 мл пробы воды (по 4 дозы из каждой пробы), тщательно втирают шпателем и инкубируют в течение 16-18 ч при температуре 37°С. Учитывают рост характерных колоний, определяют биохимические совйства бактерий и определяют коли-индекс, ориентируясь на таблицы.
Определение энтерококков
Энтерококки в последние годы привлекают к себе внимание как микроорганизмы - показатели фекального загрязнения. Они обнаруживаются в окружающей среде, куда попадают с испражнениями человека, животных, птиц, насекомых, являясь постоянными обитателями кишечника. В почве и воде они сохраняются до 6 недель, но не размножаются и не изменяют свои основные биологические свойства. Выживаемость энтерококков в воде приближается к выживаемости патогенных энтеробактерий. Они устойчивы к повышению температуры (нагревание до 55-60°С выдерживают в течение 1 ч), хорошо переносят низкую температуру, обладают значительной устойчивостью к хлору. Все это дает право считать энтерококки вторым после кишечной палочки санитарно-показательным микроорганизмом при исследовании воды.
Особое значение имеет определение энтерококков в воде плавательных бассейнов как более устойчивых к действию обеззараживающих веществ, чем БГКП.
Определение энтерококков проводят методом мембранных фильтров, титрационным, а при большой загрязненности воды (свыше 30 бактерий в 1 мл) - методом прямого посева.
Сущность метода мембранных фильтров состоит в концентрации энтерококков из определенного объема воды на мембранных фильтрах с последующим подращиванием микробов на специальных средах, идентификации и определении индекса энтерококков.
Объем воды (2-3 десятикратных разведения) выбирают с таким расчетом, чтобы на фильтрах выросло не менее 10 и не более 50 изолированных колоний (ориентируясь по таблице 5.5). Фильтры, через которые пропускают выбранные объемы воды, помещают в чашки Петри на среду Сланеца или желчную среду и инкубируют при температуре 37°С в течение 24 ч. На среде Сланеца вырастают характерные колонии: некрупные, выпуклые, круглые, темно-вишневые или розовые с темно- вишневым центром (окраска колоний зависит от степени восстановления ТТХ). На желчной среде колонии плоские, крупные с ровными краями, белые с кремовым или розовым оттенком, а также малиновые. Малиновый цвет характерен для колоний S. faecalis. Принадлежность колоний к энтерококкам подтверждается микроскопией мазков, окрашенных по Граму, и отсутствием каталазной активности (Приложение Б).
Подсчитывают количество выросших колоний и вычисляют число энтерококков в исследуемой воде исходя из объемов воды, профильтрованных через мембранные фильтры. Общее количество колоний делят на объем воды и умножают на 1000.
Сущность титрационного метода определения энтерококков заключается в посеве различных объемов исследуемой воды в жидкую элективную среду для накопления микроорганизмов с последующим высевом на плотную молочно-ингибиторную среду для получения отдельных колоний, их идентификации и подсчета индекса энтерококков. Титрационный метод дает более точные количественные данные о содержании энтерококков в воде. Объемы воды выбирают с таким расчетом, чтобы при наиболее высоком разведении наблюдался один или несколько отрицательных результатов (при этом следует ориентироваться на таблицу 5.5). Каждый объем или разбавление исследуемой воды засевают в 2 или 3 повторностях. Объемы воды 100 мл и 10 мл засевают в 100 и 10 мл (соответственно) щелочно-полимиксиновой среды двойной концентрации, 1 мл и по 1 мл десятикратных разведении засевают в 5 мл этой же среды обычной концентрации. Выдерживают в термостате в течение 24 ч при температуре 37°С, затем из всех колб и пробирок, в которых наблюдается рост бактерий (помутнение, изменение цвета среды с синего на зеленый или желтый), делают высевы на сектора в чашки Петри с молочно-ингибиторной средой. Пробирки с посевами в щелочно-полимиксиновую среду, в которых еще нет признаков роста, оставляют на сутки в термостате, и если в каких-нибудь пробирках появился рост, то также делают высев на молочно- ингибиторную среду. После 24 ч инкубирования в термостате учитывают колонии аспидно-черные, выпуклые, с металлическим блеском (S. faecalis), а также колонии, окруженные узкой зоной просветления с выпадением по периферии осадка пара-казеина (S. faecium, биовар liquefaciens), мелкие серые колонии (S. faecium, биовар durans). Из части колоний (выборочно) следует приготовить мазки, окрасить по Граму. Наличие энтерококков дает возможность дать заключительный ответ. Индекс энтерококков определяют по таблице 5.4.
При определении энтерококков методом прямого посева (в основном при исследовании сточных вод) делают посевы исследуемой воды непосредственно на чашки Петри со средой Сланеца или желчной средой в 2 или 5 повторностях. Обычно берут 1 мл, 0,5, 0,2 и 0,1 мл из каждого десятикратного разведения. Засеваемую воду тщательно втирают шпателем в поверхность питательной среды до полного впитывания воды. Идентификация и подсчет энтерококков проводятся так же, как при определении титрационным методом.
Определение споровых сульфитредуцирующих клостридий
Сульфитредуцирующие клостридии (представитель этой группы микроорганизмов - Clostridium perfringens) - спорообразующие анаэробные палочковидные микроорганизмы, редуцирующие сульфит натрия на железо-сульфитном агаре при температуре 44°С в течение 16-18 ч. Метод основан на выращивании посевов в железо-сульфитном агаре в условиях, приближенных к анаэробным, и подсчете числа черных колоний.
Количественно эти микроорганизмы в воде можно определить методом мембранной фильтрации или прямым посевом. В качестве питательной среды для выделения и подсчета сульфитредуцирующих клостридий обычно используют среду Вильсона-Блера (железосульфитный агар).
Перед посевом пробу воды прогревают на водяной бане при температуре (75±5)°С в течение 15 мин. для исключения вегетативных форм. При исследовании хлорированной воды, ее можно не прогревать. Применяя метод мембранной фильтрации, пробу воды определенного объема пропускают через фильтр, который затем помещается в пробирку с подготовленной расплавленной питательной средой верхней стороной внутрь (пробирка с питательной средой после посева должна быть немедленно охлаждена в холодной воде во избежание попадания воздуха) или в чашку Петри на поверхность питательной среды, которая затем заливается той же питательной средой толстым слоем.
Метод прямого посева предполагает посев в стерильные пробирки 20 мл воды следующим образом: по 10 мл в 2 пробирки (объемом не менее 30 мл), или по 5 мл в 4 пробирки (объемом не менее 15 мл).
Сверху посевы воды заливают горячим (75-80°С) железосульфитным агаром в количестве, превышающем объем воды в 2 раза. Среду заливают по стенке пробирки, стараясь не допустить образования пузырьков воздуха. Пробирки с посевами быстро охлаждают в стакане с холодной водой, инкубируют при 44°С в течение 24 ч.
Количественному учету подлежат только те посевы, где получены изолированные колонии. Подсчитывают черные колонии, выросшие как на фильтре, так и в толще питательной среды. Результат анализа выражают числом колониеобразующих единиц (КОЕ) спор сульфит-редуцирующих клостридий в определенном объеме воды (подвергнутой анализу).
Определение бактериофагов
Присутствие бактериофагов в воде, говорит о фекальном загрязнении, и является индикатором или сигналом о возможном присутствии энтеровирусов. Поэтому методы определения бактериофагов (в т.ч. и колифагов) включены в методические указания Минздрава Украины и регламентированы Международными стандартами (ИСО 10705-1:1995; 10705-2:2000; 10705-3; 10705-4).
Существует несколько методов количественного и качественного определения бактериофагов в воде.
Все методы основаны на чувствительности музейных культур микроорганизмов и предполагают использование следующих тест-организмов (по международным стандартам): мутант Salmonella tuphimurium, непатогенный для человека; штамм Escherichia coli К-12 Hfr из соответствующей коллекции культур ATCC 23631 или NTCT12486; штамм E.coli рода CN, называемый WG5; а также бактериофаги MS2, NCTC12487 или АТСС 15597 для контроля чувствительности тест-организмов.
Международным стандартом регламентируются методы определения бактриофагов РНК типа F и соматических бактриофагов, которые позволяют определить присутствие/отсутствие бактериофагов, а также дать их количественную оценку (ИСО 10705-1).
Бактериофаги РНК типа F - это бактериальные вирусы, способные инфицировать определенный штамм хозяина с помощью F-фимбрий или половых фимбрий. Соматические бактериофаги являются непатогенными для человека, однако являются устойчивыми к внешним факторам, особенно к высушиванию.
Прямой метод выявления бактериофагов.
Данный метод применяется при определении исследований по эпидпоказаниям или в случае необходимости получения результатов в короткие сроки.
Ход определения. За 18-24 часа перед проведением анализа необходимо сделать посев тест-культуры E. coli K12 F+ (Рос.гос.ин-т мед.и биол. препаратов им. Л.А. Тарасевича) на косяк с питательным агаром (МПА). Перед проведением анализа сделать смыв с косяка 5 мл стерильной водопроводной воды и по стандарту мутности приготовить взвесь тест-организма в концентрации 109 бакт. клеток/мл.
Расплавить и остудить до 45°С 2%-ный питательный агар. Исследуемую воду 100 мл внести в 5 стерильных чашек Петри (по 20 мл в каждую). В питательную среду добавить смыв E. coli (из расчета 1,5 мл на 150 мл агара) и хорошо перемешать. Полученной смесью залить по 30 мл сначала пустую чашку Петри (контроль), а затем все чашки, содержащие исследуемую воду. Содержимое чашек перемешивают вращательными движениями. После застывания питательной среды чашки переворачивают вверх дном и ставят для инкубирования в термостат при 37°С на 18-24 ч.
Учет результатов проводят путем подсчета и суммирования бляшек, выросших на 5-ти чашкках Петри. Результаты выражают в бляшкообразующих единицах (БОЕ) на 100 мл воды.
В контрольной пробе бляшки должны отсутствовать.
Санитарно-микробиологическая оценка воды
Оценка качества воды производится комплексно: по санитарно-микробиологическим показателям с учетом органолептических, гельминтологических и химических данных и регламентируется соответствующими ГОСТами, Санитарными правилами и методическими указаниями. Безусловным показателем загрязненности воды является обнаружение патогенных микроорганизмов. В этом случае вода считается непригодной для любых целей.
Критерии оценки качества воды разработаны дифференциально в зависимости от категории воды и ее назначения представлены в Приложении В.
При оценке питьевой воды руководствуются основным требованием: она не должна содержать патогенные бактерии и вирусы. При санитарно-бактериологической оценке воды колодцев исходят из того, чтобы в 1 л БГКП содержалось не более 10. Показателем фекального загрязнения воды колодцев является обнаружение энтерококков. Отсутствие обеззараживания колодезной воды, возможность биологической контаминации (осадки, просачивание загрязненных ливневых и грунтовых вод и т.д.) делают ее эпидемически опасной, и поэтому требуется постоянный контроль. При обнаружении в воде энтерококков вода считается непригодной к употреблению, и колодец подлежит очистке.
Если при выборе нового источника водопользования коли-индекс воды водоема превышает 10000 в 1 л, то проводится дополнительное исследование на присутствие Е. coli и энтерококков как показателей свежего фекального загрязнения и непосредственное обнаружение патогенных бактерий - сальмонелл и шигелл.
При индексе Е. coli, энтерококков более 1000 в 1 л вода водоема расценивается как загрязненная, причем контаминация считается свежей, а вода - опасной в эпидемическом отношении. В последние годы разработаны и предложены [Григорьева Л. В., 1975] дополнительные критерии оценки санитарного состояния водоемов, в которые включены показатели титра энтерококков, перфрингенс-титр и индекс бактериофагов.
5.2. Экспериментальная часть
Порядок выполнения работы:
1) Провести посев проб воды методом бродильных проб для определения показателей.
2) Сделать пересев со среды ГПС (Кесслер) на дифференциально-диагностическую среду Эндо.
3) Провести биохимические тесты колоний, выросших на среде Эндо.
4) Определить количественные показатели санитарного состояния воды (индекс ОКБ, ТКБ, сульфит-редуцирующих клостридий, общую обсемененность).
5) Дать оценку санитарного состояния водного объекта, откуда была взята проба воды. Возможность использования воды на питьевые цели.
Алгоритм работы

Контрольные вопросы:
1. Какими факторами определяются количественный и качественный состав микрофлоры воды?
2. Какой объем воды отбирается для санитарно-микробиологических исследований? Рассмотреть все случаи.
3. Какие виды микроорганизмов определяются в воде питьевой в качестве санитарно-показательной микрофлоры?
4. Как регламентируется время между отбором проб и началом микробиологических исследований нормативно-техническими документами?
5. При какой температуре транспортируют отобранные пробы воды? Почему?
6. В каких случаях в воде определяются патогенные микроорганизмы (какие)? Какие методы для этого применяют?
7. На каких свойствах микроорганизмов основаны ускоренные методы определения патогенных микроорганизмов? В чем заключаются их недостатки?
8. Какими биохимическими признаками должен обладать выделенный микроорганизм, чтобы его можно было отнести к E. coli? Какими показателями отличаются E.coli от ЛКП?
9. В каких случаях для определения количества сапрофитных микроорганизмов может использоваться прямой метод? В чем он заключается?
10. Объясните цель раздельного определения количества мезофильных и термофильных сапрофитов в воде.
Дата добавления: 2021-02-19; просмотров: 1604;











