Виды химических связей
Основными элементарными частицами, из которых построены все вещества являются протоны, нейтроны и электроны. Из протонов и нейтронов состоят атомные ядра; электроны заполняют оболочки ядра атома, компенсируя положительный заряд протонов ядра. При сближении атомов до расстояния в несколько ангстрем между ними возникают силы взаимодействия, которые могут быть как силами притяжения, так и силами отталкивания. Наличие тех или иных сил приводят и к упорядоченной структуре твёрдых тел, и к образованию химически устойчивых соединений. Электроны внутренних (ближних к ядру) полностью заполненных оболочек прочно связаны с ядром и не участвуют в образовании химических связей. Химические свойства определяются строением внешней, не полностью заполненной электронами оболочки. Электроны, находящиеся на внешней оболочке, называются валентными.
Во всех соединениях связь атомов обусловлена силами электростатического взаимодействия валентных электронов и ядер. В зависимости от строения внешних электронных оболочек атомов, вступивших в соединения, могут образовываться различные виды связи.
Ковалентная связь. В этом случае связь атомов друг с другом устанавливается при так называемом обобществлении электронов – т.е. за счёт электронов, которые становятся общими для всех атомов тела. Ковалентная (её ещё называют гомеополярной) связь характерна для молекул, образованных из металлоидных атомов (хлор, этилен) и в атомных кристаллах – в кристаллах алмаза, кремния , германия и др. На рисунке 1.3. показан пример образования двухатомной молекулы с ковалентной связью для случаев нейтральной (рис. 1.2 – а), симметричной (рис. 1.2 – б) и несимметричной (рис. 1.2 – в) молекул.
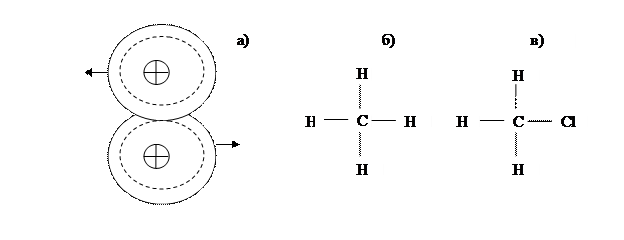
Рисунок 1.3. Схематическое изображение двухатомной молекулы с ковалентной связью а); нейтральная (симметричная) – б) и дипольная (несимметричная) – в) молекулы.
Валентные электроны атомов, соединившихся в молекулу, имеют противоположные направления моментов собственного вращения и каждый из них может вращаться вокруг любого ядра. Молекулы с ковалентной связью могут быть неполярными (нейтральными) или полярными (дипольными), им соответствует симметричное и несимметричное строение молекулы. Центры противоположных по знаку зарядов в неполярных молекулах совпадают, поэтому они электрически нейтральны. Если же центры положительных и отрицательных зарядов расположены на некотором расстоянии друг от друга, то образуется полярная, или дипольная молекула. Пример нейтральной и дипольной молекул показан на рисунке 1.3. Полярность молекулы характеризуется величиной дипольного момента, который определяется произведением заряда на расстояние между центрами зарядов противоположных знаков.
Ковалентная связь характеризуется направленностью действия и сосредоточенностью в пространстве, что приводит к тому, что кристаллы с ковалентной связью твёрдые, прочные, обладают высокой температурой плавления. При нуле градусов Кельвина такие материалы являются диэлектриками, а при повышении температуры они становятся полупроводниками.
Ионная(гетерополярная)связь.Этот вид связи образуется при взаимодействии положительных и отрицательных ионов из-за наличия между ними сил электростатического притяжения и наблюдается у некоторых жидкостей (вода, растворы щелочей, кислот и др.), а так же у многих твёрдых неорганических веществ. Жидкости с ионной связью являются проводниками второго рода (электролиты), а твёрдые ионные соединения могут быть диэлектриками или полупроводниками. В ионных кристаллах нет отдельных молекул, ибо каждый положительный ион окружён некоторым числом отрицательных ионов и наоборот. Число Z ближайших соседних ионов противоположного знака, окружающих данный ион называется координационным числом. Например, для кристаллов NaCl Z = 6 (каждый ион Na окружён шестью ионами Cl и наоборот), для кристаллов CsCl координационное число Z = 8.
Металлическая связь.Характеризуется обобществлением свободных электронов, которые в данном случае принадлежат всем атомам металлического кристалла. Свободные электроны взаимодействуют с положительными ионами решётки, «стягивая» их и уравновешивая силы отталкивания положительных ионов. Специфика металлической связи состоит в том, что в обобществлении электронов участвуют все атомы кристалла (а не только соседние, как при ковалентной связи) и обобществлённые электроны не локализуются вблизи своих атомов, а свободно перемещаются по всей решётке, образуя «электронный газ). Благодаря наличию свободных электронов металлы имеют высокую электропроводность и высокую теплопроводность.
Молекулярная связь(связь Ван-дер-Ваальса). Этот вид связи наблюдается у веществ с ковалентным характером внутримолекулярного взаимодействия. Межмолекулярное взаимодействие возникает при согласованном движении электронов в соседних молекулах. Существует три типа молекулярной связи: дисперсионное, ориентационное и индукционное взаимодействие (см. рис.1.4.)
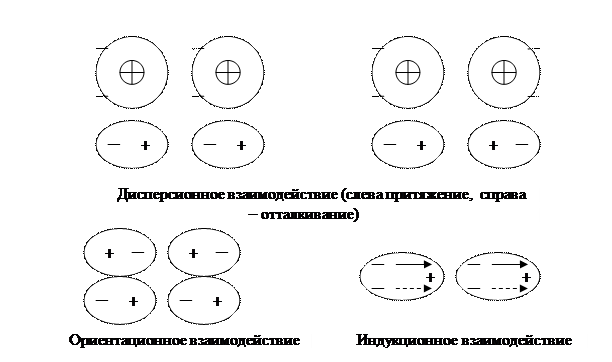
 Рисунок 1.4. Примеры молекулярных связей.
Рисунок 1.4. Примеры молекулярных связей.
Дисперсионное взаимодействие возникает у атомов способных к поляризации при их сближении, что и приводит к возникновению электростатических сил притяжения или отталкивания. У изолированных атомов этих веществ (например, гелия) атомы обладают сферической симметрией и их электрический момент равен нулю. Ориентационное взаимодействие возникает у поляризованных молекул за счёт электростатического взаимодействия диполей, которое упорядычивает их положение. Наконец, индукционное взаимодействие возникает между сильно поляризованными молекулами, когда собственные сильные диполи наводят (индуцируют) электрические диполи в соседних молекулах (на рисунке 1.4. собственные диполи при индукционном взаимодействии показаны сплошными стрелками, а наведённые – пунктирными). Взаимодействие собственных и индуцированных диполей и приводит к упорядочиванию структуры вещества.
Связь Ван-дер-Ваальса – наиболее универсальная связь, она возникает между любыми частицами, но это наиболее слабая связь, энергия её примерно на два порядка ниже ионной и ковалентной связей.
Дата добавления: 2016-11-26; просмотров: 2689;











